Формула фосфата аммония
Определение и формула фосфата аммония

Средняя соль — фосфат аммония широко применения и известности не имеет.
Более важное значение имеет кислая соль — гидрофосфат аммония.
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые термически не устойчивые кристаллы кристаллы.
При хранении на воздухе постепенно разлагается.
Хорошо растворяется в воде.
Химические свойства фосфата аммония
- При нагревании выше
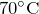 разлагается на дигидрофосфат аммония и аммиак:
разлагается на дигидрофосфат аммония и аммиак:
![Rendered by QuickLaTeX.com \[ (NH_4)_2HPO_4 = NH_4(H_2PO_4) + NH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4103c9b0933c16cc49483862762ac342_l3.png)
- Реагирует с концентрированным раствором щелочи:
![Rendered by QuickLaTeX.com \[ (NH_4)_2HPO_4 + 3NaOH = Na_3PO_4 + 2NH_4OH + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2502c0ea953d63122e7aa85558f6bc34_l3.png)
- Вступает в реакции обмена с солями:
![Rendered by QuickLaTeX.com \[ 2(NH_4)_2HPO_4 + 3AgNO_3 = Ag_3PO_4 \downarrow + 2NH_4NO_3 + NH_4(H_2PO_4) \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-76d249a8fcddb3153feaf100c50af27c_l3.png)
Получение
Фосфат аммония можно получить по реакции обмена между гидроксидом аммония и фосфорной кислотой:
![]()
Применение
Данная моль находит применение как сложное концентрированное фосфорно-азотное удобрение и как огнезащитное средство.
Примеры решения задач
| Задание | Сколько грамм фосфора потребуется для получения |
| Решение | Запишем гипотетическую реакцию образования Из стехиометрии реакции найдем количество моль P: Определим массу фосфора и его долю: |
| Ответ |
| Задание | Сколько литров аммиака можно получить из |
| Решение | Запишем химическую реакцию разложения фосфата аммония при нагревании:
Определим количество моль где Из стехиометрии реакции следует, что
Вычислим объем аммиака по уравнению состояния идеального газа:
Выразим из уравнения объем и подставим числовые значения: |
| Ответ | Объем аммиака равен |











