Спирты
В зависимости от числа гидроксильных групп спирты делят на одно- (CH3OH — метанол, 2H5OH — этанол), двух- (CH2(OH)-CH2-OH — этиленгликоль) и трехатомные (CH2(OH)-CH(OH)-CH2-OH — глицерин). В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают первичные (R-CH2-OH), вторичные (R2CH-OH) и третичные спирты (R3C-OH). В названии спиртов присутствует суффикс – ол.
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов CnH2n+1OH.
Изомерия
Для предельных одноатомных спиртов характерна изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовая изомерия с простыми эфирами.
СН3-СН2-СН2-СН2-ОН (бутанол – 1)
СН3-СН(СН3)- СН2-ОН (2-метилпропанол – 1)
СН3-СН(ОН)-СН2-СН3 (бутанол – 2)
СН3-СН2-О-СН2-СН3 (диэтиловый эфир)
Физические свойства
Низшие спирты (до С15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в оде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.
Получение спиртов
Получение спиртов возможно с помощью биотехнологического (брожение) способа из древесины или сахара.
К лабораторным способам получения спиртов относятся:
— гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
СН2=СН2 + Н2О → СН3ОН
— гидролиз алкилгалогенидов под действием водных растворов щелочей
СН3Br + NaOH → CH3OH + NaBr
СН3Br + Н2О → CH3OH + HBr
— восстановление карбонильных соединений
CH3-CH-O + 2[H] → CH3 – CH2-OH
Химические свойства
1. Реакция, протекающие с разрывом связи О-Н:
— кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
2C2H5OH + 2K → 2C2H5OK + H2
но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются:
C2H5OK + Н2О → C2H5OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода
— образование сложных эфиров под действием минеральных и органических кислот:
CH3-CO-OH + H-OCH3 ↔ CH3COOCH3 + H2O
— окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты.
R-CH2-OH + [O] → R-CH=O + [O] → R-COOH
Вторичные спирты окисляются в кетоны:
R-CH(OH)-R’ + [O] → R-C(R’)=O
Третичные спирты более устойчивы к окислению.
2. Реакция с разрывом связи С-О.
— внутримолекулярная дегидратация с образованием алкенов (происходит при сильном нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
CH3-CH2-CH2-OH → CH3-CH=CH2 + H2O
— межмолекулярная дегидратация спиртов с образованием простых эфиров (происходит при слабом нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
2C2H5OH → C2H5-O-C2H5 + H2O
— слабые основные свойства спиртов проявляются в обратимых реакциях с галогеноводородами:
C2H5OH + HBr →C2H5Br + H2O
Примеры решения задач
| Задание | Определите молярную массу и строение спирта, если известно, что при взаимодействии 7,4 г этого спирта с металлическим натрием выделяется 1,12 л газа (н.у.), а при окислении оксидом меди(II) образуется соединение, которое дает реакцию «серебряного зеркала». |
| Решение | Составим уравнения реакций спирта ROH с: а) натрием; б) окислителем CuO:
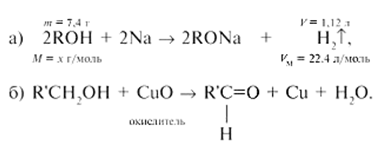
Из уравнения (а) методом отношений определим молярную массу неизвестного спирта: 7,4/2х = 1,12/22,4, х = М(ROH) = 74 г/моль. Такую молярную массу имеют спирты С4Н10О. Причем согласно условию задачи [уравнение (б)] это могут быть первичные спирты – бутанол-1 СН3СН2СН2СН2ОН или 2-метилпропанол-1 (СН3)2СНСН2ОН. |
| Ответ | М(С4Н10О) = 74 г/моль, это бутанол-1 или 2-метилпропанол-1 |
| Задание | Какой объем (в л) кислорода (н.у.) потребуется для полного сгорания 31,25 мл этилового спирта (плотность 0,8 г/мл) и сколько граммов осадка получится при пропускании продуктов реакции через известковую воду? |
| Решение | Найдем массу этанола:
m = Количество вещества, соответствующее такой массе:
Запишем уравнение реакции горения этанола: 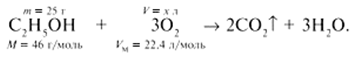
Объем кислорода, расходуемого при сгорании этанола: V (O2) = 25×3×22,4/46 = 36,5 л. Согласно коэффициентам в уравнении реакции:
Реакция газа СО2 с известковой водой: 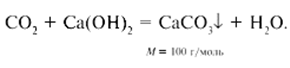
Количество вещества: Это соответствует массе:
m
(СаСО3) = |
| Ответ | V(О2) = 36,5 л, m(СаСО3) = 109 г |











