Спирт
Характеристики и физические свойства спиртов
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Строение молекулы спиртов на примере этанола показано на рис. 1. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Для низших нормальных (неразветвленных) первичных спиртов разность температур кипения гомологов составляет примерно 20oС.
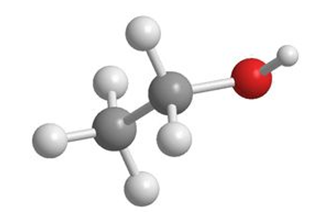
Рис. 1. Строение молекулы этанола.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов резко падает.
Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Получение спиртов
Получение одноатомных спиртов можно осуществить следующими способами:
— гидролиз моногалогеналканов водными растворами щелочей
C2H5Br + NaOHaq→C2H5OH + NaBr (t0);
— гидратация алкенов (применяетсявпромышленности)
CH2=CH2 + H2O → CH3-CH2-OH (H+, t0);
-гидрирование альдегидов и кетонов
CH3-CH2-C(O)H + H2→ CH3-CH2-CH2OH (kat = Ni, t0);
CH3-C(O)-CH2-CH3 + H2→ CH3-CH(OH)-CH2-CH3 (kat = Ni, t0).
Химические свойства спиртов
Для спиртов возможны реакции, протекающие с участием:
— атома водорода гидроксильной группы;
— гидроксильной группы;
— атома водорода гидроксильной группы и связи Cα-H;
— гидроксильной группы и связи Cβ-H.
Таким образом, все химические превращения спиртов сопровождаются расщеплением связей:
- O-H
— взаимодействие с активными металлами
2C2H5OH + 2Na → 2C2H5ONa + H2↑.
— взаимодействие с органическими и кислородсодержашими неорганическими кислотами
C2H5OH + CH3COOH ↔C2H5-O-C(O)-CH3 + H2O (H2SO4 (conc), t0);
C2H5OH + HONO2↔C2H5ONO2 + H2O (H2SO4 (conc), t0).
- C-OH;
— взаимодействие с галогеноводородами
C2H5OH + HCl→ C2H5Cl + H2O (ZnCl2, t0).
— взаимодействие с тригалогенидамифосфора
3C2H5OH + PBr3→ 3C2H5Br + H3PO3.
— взаимодействие с аммиаком
C2H5OH + NH3→ C2H5NH2 + H2O (Al2O3, t0 = 300).
- O-H и Ca-H;
— дегидрирование
CH3-CH2-OH → CH3-C(O)H + H2↑ (kat = Cu, t0).
— окисление
CH3-CH2-CH2-OH + 2[O] → CH3-CH2-COOH + H2O (kat, t0).
- C-OH и Cb-H
— внутримолекулярная дегидратация
CH3-CH2-OH → CH2=CH2 + H2O (Al2O3, t0).
Спирты проявляют слабые амфотерные свойства: кислотные за счет атома водорода гидроксильной группы, основные – за счет неподеленной пары электронов атома кислорода.
Применение спиртов
Спирты нашли широкое применение в различных отраслях народного хозяйства. Так, например, этанол широко используется в промышленном органическом синтезе. В фармации он применяется для приготовления настоек и экстрактов; в медицинской практике – как наружное антисептическое средство для дезинфекции рук и хирургических инструментов.
Примеры решения задач
| Задание | Найдите молекулярную формулу спирта, плотность которого равна 2,68 г/л, если при сгорании 1,2 г паров его образуется 1,344 л (н.у.) оксида углерода (IV) и 1,49 г воды. Запишите уравнение реакции горения этого вещества. |
| Решение | Формулу спирта в общем виде обозначим как CxHyOz. Составим схему реакции сгорания спирта:
CxHyOz + Oz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [V(CO2) / Vm]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)] ×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [1,344 / 22,4]×12 = 0,72 г; m(H) = 2×1,49 / 18 ×1= 0,165 г. m(O) = m(CxHyOz) – m(C) – m(H) = 1,2 – 0,72 – 0,165 = 0,315г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z = 0,72/12 : 0,165/1 : 0,315/16; x:y:z = 0,06 : 0,165 : 0,02 = 3 : 8 : 1. Значит простейшая формула соединения C3H8O, а его молярная масса равна 60 г/моль [M(C3H8O) = 3×Ar(C) + 8×Ar(H) + Ar(O) = 3×12 + 8×1 + 16 = 60 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности: Msubstance = 2,68 × 22,4 = 60 г/моль. Чтобы найти истинную формулу спирта найдем отношение полученных молярных масс: Msubstance / M(C3H8O) = 60 / 60 = 1. Значит спирт имеет формулу C3H8O. Это пропанол-1 или пропанол-2. |
| Ответ | Формула спирта C3H8O. Это пропанол-1 или пропанол-2. |
| Задание | К метиловому спирту массой 32 г и плотностью 0,8 г/л добавили воду до объема 80 мл. Определите объемную долю спирта в растворе. |
| Решение | Найдем объем растворенного спирта:
V = m / r; V(CH3OH) = m(CH3OH) / r (CH3OH); V(CH3OH) = 32 / 0,8 = 40 мл. Рассчитаем объемную долю спирта в растворе: φ(CH3OH) = V(CH3OH) / Vsolution; φ(CH3OH) = 40 / 80 = 0,5 = 50%. |
| Ответ | Объемная доля метанола в растворе равна 50%. |











