Формула спирта
Определение и формула спирта
Спирты можно рассматривать как производные воды ![]() , в которых один атом водорода замещен на органическую функциональную группу.
, в которых один атом водорода замещен на органическую функциональную группу.
Общая формула спиртов: ![]()
Структурная формула метанола, простейшего спирта, ![]()
Соединения, в которых гидроксильная группа связана с ненасыщенным атомом углерода, по номенклатуре ИЮПАК (IUPAC) называются енолы (гидроксильная группа связана с двойной связью C=C). Соединения, в которых гидроксильная группа связана с бензольным или любым другим ароматическим циклом называются фенолы.
Классификация и структура спиртов
- По числу гидроксильных групп:

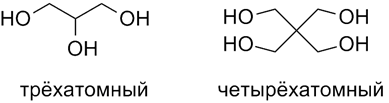
- В зависимости от насыщенности углеводородного заместителя:
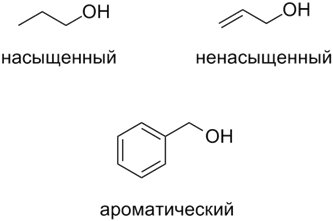
- В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
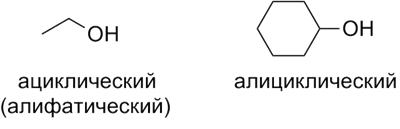
- В зависимости от положения гидроксильной группы:
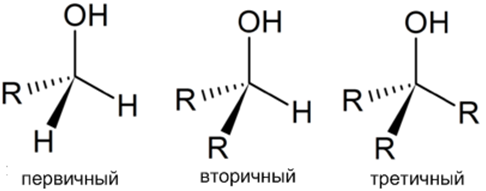
Формулы разных спиртов
Общая формула предельных одноатомных спиртов: ![]()
Общая формула двухатомных спиртов (гликолей, диолов): ![]()
Общая формула трехатомных спиртов (триолов): ![]()
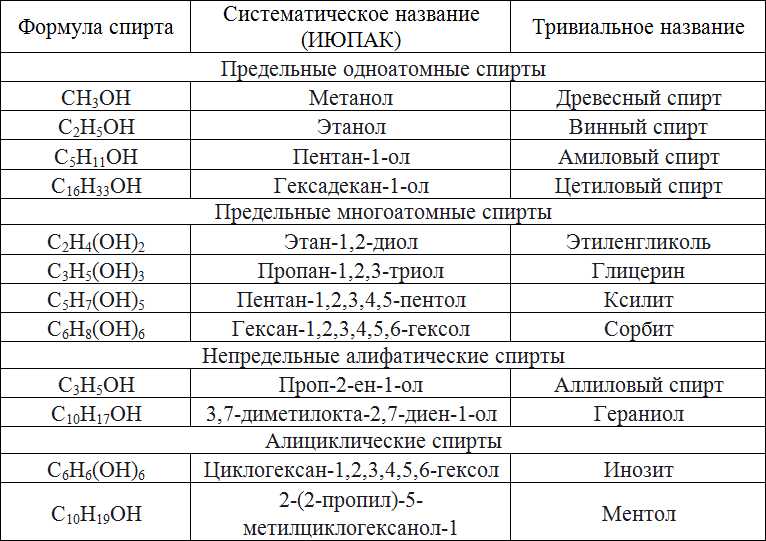
Для многих спиртов наряду с систематическими часто употребляются тривиальные названия:
Примеры решения задач
| Задание | При какой температуре будет замерзать 5%-ный раствор этилового спирта |
| Решение | Согласно следствию из закона Рауля понижение температуры замерзания раствора по сравнению с чистым растворителем равно:
Где: Пусть масса раствора равна 100 г., тогда масса этилового спирта равна 5 г., а масса растворителя (воды) будет равна
Формула этилового спирта Рассчитаем изменение температуры замерзания раствора: Температура кристаллизации воды равна |
| Ответ | Раствор будет замерзать при |
| Задание | Сколько мл раствора формалина с массовой долей формальдегида 40% ( |
| Решение | Запишем уравнение реакции получения формальдегида:
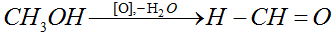
Найдем, массу исходного раствора метилового спирта по формуле: где
Найдем массу метилового спирта в растворе. Выражение для массовой доли вещества в растворе: Если раствор Выразим массу метилового спирта:
Молярные массы метилового спирта и формальдегида равны:
Для нахождения массы формальдегида, образовавшегося при полном окислении метилового спирта, составим пропорцию исходя из уравнения реакции: при окислении 32 г при окислении 96 г Отсюда: Рассчитаем массу раствора формалина по формуле: Если раствор Рассчитаем объем раствора формалина по формуле:
|
| Ответ | Объем раствора формалина равен 204,5 мл. |











