Плотность спирта
Плотность спирта и другие его физические свойства
В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и т.д. Двухатомные спирты часто называют гликолями по названию простейшего представителя этой группы – этиленгликоля. Спирты, содержащие большее количество гидроксильных групп обычно объединяют общим названием многоатомные спирты.
В зависимости от характера углеводородного радикала спирты делятся на алифатические, алициклические и ароматические. В отличие от галогенпроизводных, у ароматических спиртов гидроксильная группа не связана непосредственно с атомом углерода ароматического кольца. Соединения, гидроксильная группа которых непосредственно связана с ароматическим кольцом, называются фенолами.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Важнейшие константы некоторых спиртов представлены в таблице ниже:
Таблица 1. Физические свойства и плотность спиртов.
|
Отдельные представители |
Параметр |
|||
|
Название |
Структурная формула |
Плотность, кг/м3 |
tкип, oC |
tпл, oC |
|
Метанол |
CH3OH |
792 |
64,5 |
-97 |
|
Этанол |
CH3CH2OH |
789 |
78 |
-115 |
|
Пропанол – 1 |
CH3CH2CH2OH |
803 |
97 |
-127 |
|
Пропанол – 2 |
CH3CH(OH)CH3 |
786 |
82,5 |
-86 |
|
2-метилпропанол-2 |
(CH3)2CHCH2OH |
781 |
108 |
-108 |
|
Этиленгликоль |
HOCH2CH2OH |
1113 |
199 |
-17 |
|
Глицерин |
HOCH2CH(OH)CH2OH |
1261 |
290 |
20 |
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в оде резко падает. Высшие спирты практически не растворимы в воде.
Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
Спирты обладают аномально высокими температурами кипения по сравнению с представителями таких классов органических соединений, как алканы, галогеналканы, тиолы, амины. Например, температура кипения этанола 78o, тогда как хлорэтана – 13oС, а этана – 88,5oС. Эти различия объясняются особенностями строения спиртов.
Химический состав и плотность спирта
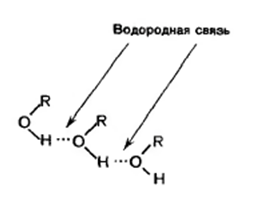
Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность s-связей связанных с ним атомов, в частности атома водорода. Связь O-H в молекуле спирта сильно поляризована на R→O←H. Электронная плотность на атоме водорода оказывается пониженной. Поэтому он может взаимодействовать с неподеленной парой электронов атома кислорода другой молекулы спирта. Между двумя молекулами возникает нековалентная водородная связь (графически водородную связь принято изображать точками). Молекулы, связанные между собой водородными связями, образуют ассоциаты:
Примеры решения задач
| Задание | Вычислите плотность озона O3 по азоту и по воздуху. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
DN2(O3) = Mr(O3) / Mr(N2); DN2(O3) = 48 / 28 = 1,71. Dair(O3) = Mr(O3) / Mr(air); Dair(O3) = 48 / 29 = 1,66. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. |
| Задание | Вычислите плотность во водороду следующих газов: а) азота; б) гелия; в) бутана C4H10; г) фосгена COCl2. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Mr(N2) = 2 ×Ar(N) = 2 × 14 = 28. Mr(H2) = 2 ×Ar(H) = 2 × 1 = 2. Mr(He) = Ar(He) = 4. Mr(C4H10) = 4 ×Ar(C) + 10 ×Ar(H) = 4 ×12 + 10 × 1 = 48 + 10 = 58. Mr(COCl2) = Ar(C) + Ar(O) + 2 ×Ar(Cl) = 12 + 16 + 2 × 35,5 = 28 + 71 = 99. DH2(N2) = Mr(N2) / Mr(H2) = 28 / 2 = 14. DH2(He) = Mr(He) / Mr(H2) = 4 / 2 = 2. DH2(C4H10) = Mr(C4H10) / Mr(H2) = 58 / 2 = 29. DH2(COCl2) = Mr(COCl2) / Mr(H2) = 99 / 2 = 49,5. |
| Ответ | Плотности азота, гелия, бутана и фосгена по водороду соответственно равны 14, 2, 29 и 49,5. |











