Строение вещества
Атомно–молекулярное учение
Изучение строения вещества стало возможным после создания атомно-молекулярного учения. Одним из первых строение вещества стал изучать М.В. Ломоносов, применивший теорию, согласно которой все вещества включают в свой состав «корпускулы». Этим термином Ломоносов называл молекулы. Корпускулы состоят из «элементов». Этот термин Ломоносов применял для обозначения атомов. Все частицы (и атомы, и молекулы) непрерывно движутся. Молекулы простых веществ состоят из одинаковых атомов, а сложных – из различных атомов. Учение М.В. Ломоносова нашло дальнейшее развитие в работах Дж. Дальтона, который сделал первые попытки определить атомные массы известных в то время элементов. Однако он отрицал наличие молекул в простых веществах, утверждая, что простое вещество состоит лишь из одних атомов, а сложные вещества состоят из «сложных атомов».
Согласно современным представлениям, молекулы составляют парообразные и газообразные тела. В твердых телах присутствие молекул возможно только при наличии кристаллической решетки, имеющей молекулярное строение.
В атомно-молекулярном учении имеется несколько базисных утверждений: наличие между частицами определенных промежутков, размеры которых зависят от температуры и агрегатного состояния объекта. Наибольшие промежутки между молекулами наблюдаются в газообразных телах, что обуславливает их способность легко сжиматься. Значительно меньше расстояние между молекулами в жидкостях, поэтому они сжимаются труднее. Твердые тела практически не поддаются сжатию, т.к. промежутки между частицами имеют небольшой размер.
Молекулы постоянно находятся в движении. Чем выше температура тела, тем выше скорость движения. Наличие сил взаимного отталкивания и притяжения между молекулами. Молекулы состоят из атомов, находящихся в непрерывном движении. Атомов отличаются друг от друга по своим свойствам и массе. Вещества в твердом агрегатном состоянии, обладающие кристаллической решеткой, имеют в узлах этих решеток молекулы. Связи между атомами и молекулами в таких веществах слабые и разрываются при нагревании, что придает им такие физические свойства как низкая температура плавления.
Молекулы
Однако свойства, которые характерны для одной молекулы, могут быть характерными и для целой группы молекул.
Рассмотрим следующие примеры: молекулы, имеющие разный качественный состав
H2 (водород), N2 (азот), O2 (кислород), F2 (фтор), Sn (сера), C (алмаз)
молекулы, имеющие одинаковый качественный, но различный количественный состав
N2O (оксид азота (I)), NO (оксид азота (II)), N2O3 (оксид азота (III)),
NO2 (оксид азота (IV)), N2O4 (оксид азота (IV)), N2O5 (оксид азота (V))
молекулы, обладающие разным качественным и количественным составом
HNO3 (азотная кислота), CH3OH (метиловый спирт), SiO2 (оксид кремния).
Структура молекулы складывается из молекулярной и электронной структур. Молекулярная структура включает типы и порядок расположения атомов молекулы в пространстве, длины связей, углы между ними, т.е. координаты всех атомов, входящих в состав молекулы. Реакционная способность – свойство молекулы вступать в химическое взаимодействие с другими молекулами. Она зависит от прочности химических связей внутри молекулы, а также её пространственного строения.
Молекулярная и электронная структуры связаны между собой. Информацию о молекулярной структуре получают из экспериментальных данных, а об электронной – с применением различных теорий электронного строения.
Число атомов в молекуле не ограничено, так, например молекулы газообразных веществ могут иметь в своем составе один атом (Ar), два (O2) или более (S8, (C738H1165O208N203S2Fe)n — гемоглобин). Молекулы, содержащие повторяющиеся группы атомов общей численностью не более 100 называют олигомерами, более крупные – полимерами.
Молекула конкретного состояния не обязательно должна существовать при нормальных условиях. Так, молекулы щелочных металлов при н.у. полимерны, а при высокой температуре, в газовой фазе – двухатомны.
Объединение атомов в молекулы происходит за счет образования химических связей. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер. Для объяснения свойств химических связей используют разнообразные подходы, из которых наибольшую значимость имеют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Метод валентных связей
МВС основан на предположении о том, что химическая связь обеспечивается 2-мя электронами, движущимися в ограниченном участке электростатического поля двух ядер – концепция двухэлектронных локализованных связей. МВС позволяет понять способность атомов к образованию определенного числа ковалентных связей, дает удовлетворительное описание структуры и свойств большого числа молекул. Согласно МВС все ковалентные связи осуществляются общей парой электронов (рис. 1).
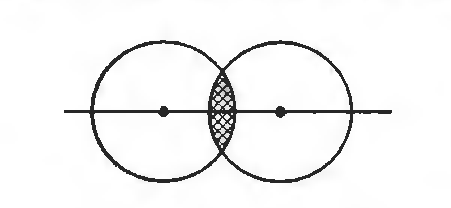
Рис. 1. Схема перекрывания 1s-электронов в молекуле водорода.
Метод молекулярных орбиталей
ММО представляет собой естественное распространение модели атома, как системы из ядра и электронных оболочек, на случай молекулы. Вся молекула рассматривается как единое целое, состоящее из ядер (вывших атомов) и электронов (ранее принадлежавших атомам. Все электроны являются общими для всех ядер, т.е. химические связи – многоцентровые, каждая связь простирается между всеми ядрами. в той или иной степени. Состояние электронов в молекуле описывается решением соответствующего уравнения Шредингера для молекулярной системы.
Распределение электронов по молекулярным орбиталям в рамках одноэлектронного приближения основано на тех же принципах, что и в строении атома – принципе Паули, правилах Клечковского и правиле Хунда (рис. 2)
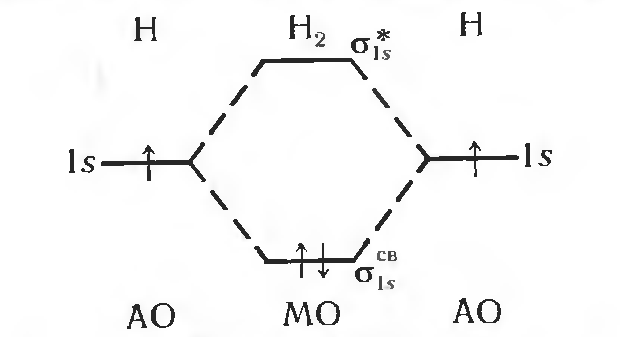
Рис. 2. Схема молекулярных орбиталей молекулы водорода.
Примеры решения задач
| Задание | Какое из веществ имеет полимерное строение: белый фосфор, кристаллическая сера, озон, сера пластическая? |
| Решение | Сера пластическая. |
| Задание | Соотнесите тип вещества (простое или сложное) с его названием: фосфор, алмаз, ксенон, фосфин, хлороводород, мочевина |
| Решение | Простые – фосфор, алмаз, ксенон, сложные – мочевина, хлорододород, фосфин. |











