Формула простого вещества
Определение и формула простого вещества
Для металлов характерна металлическая связь, для неметаллов – ковалентная. Резкого различия между металлическими и неметаллическими простыми веществами нет. К металлам примыкают металлоподобные простые вещества, к неметаллам – неметаллоподобные.
Один и тот же элемент может образовывать несколько типов простых веществ, называемых аллотропными модификациями. Известно свыше 400 разновидностей простых веществ. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Рассмотрим для примера типы и структуру простых веществ, образованных элементами третьего периода. Так, у р-элемента VIII группы аргона (3s23p6), имеющего завершенную валентную оболочку, молекула одноатомна. Между атомами аргона возможно только дисперсионное взаимодействие. Поэтому в твердом состоянии кристаллы аргона и его аналогов молекулярные.
Для хлора (3s23p5) объединение атомов в молекулу может осуществляться только одним способом, а именно за счет образования двухатомной ковалентной молекулы Cl2, имеющей форму гантели. Кристаллы хлора образованы молекулами, подобно кристаллами йода.
По мере увеличения числа неспаренных электронов для элементов становится возможной аллотропия состава. Так, для атомов серы (3s23p4), имеющих два непарных электрона, наиболее типично объединение в зигзагообразные цепи (I). В обычных условиях этому соответствует геометрическая форма молекулы в виде зигзагообразной цепочки, замкнутой в восьмичленное кольцо S8 (II):
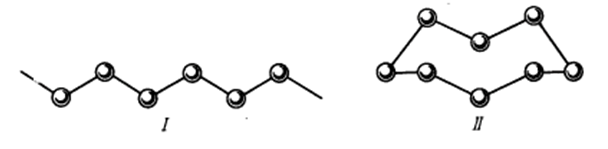
Кроме молекул S8 в соответствующих условиях существуют молекулы серы в виде зигзагообразных открытых цепей и колец S6, S4, а также гантелевидные молекулы S2.
Атомы фосфора (3s23p3), имеющие три неспаренных электрона, объединяются в полимерные слои с пирамидальным распределением связей (I); кроме того, атомы фосфора образуют четырехатомные молекулы P4тетраэдрической формы (II):
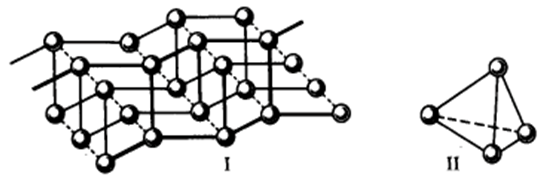
Для кремния (3s23p2) наиболее устойчива трехмерная (координационная) структура типа алмаза. Это строение можно объяснить в рамках представления о sp3-гибридизации орбиталей кремния.
Примеры решения задач
| Задание | При сжигании смеси, состоявшей из двух объемов неизвестного газа и полутора объемов кислорода, образовалась смесь из одного объема азота и трех объемов водяного пара. Во всех случаях объемы газов измерены при одинаковых условиях. Какова формула неизвестного газа? |
| Решение | Так как при сгорании неизвестного газа в кислороде образуются молекулярный азот (N2) и вода (H2O), то в состав газа входят азот, водород и, возможно, кислород. Обозначим количество атомов каждого из указанных химических элементов как «х», «у» и «z». Тогда формула неизвестного газа в общем виде будет записываться как NxHyOz.
Согласно закону объемных отношений, объемы газов пропорциональны их количествам вещества и равны коэффициентам в уравнении реакции. С учетом этого напишем уравнение реакции сгорании неизвестного газа в кислороде в общем виде: 2NxHyOz + 3/2 O2 = N2 + 3H2O. По закону сохранения массы веществ число атомов каждого элемента в левой и правой частях уравнения одинаково, поэтому 2х = 2; отсюда х = 1; 2у = 6; у = 3; 2z + 3 = 3; z = 0. Следовательно, формула неизвестного газа NH3. Это аммиак. |
| Ответ | NH3. Это аммиак. |
| Задание | Выведите формулу кристаллогидрата фосфата цинка, если известно, что массовая доля соли в нем равна 84,2%. |
| Решение | Пусть в состав формульной единицы кристаллогидрата входит n молекул воды, т.е. формула данного кристаллогидрата Zn3(PO4)2×nH2O.
Рассчитаем молекулярную массу безводной соли: Mr(Zn3(PO4)2) = 3×Ar(Zn) + 2×Ar(P) + 8×Ar(O); Mr(Zn3(PO4)2) = 3×65 + 2×31 + 8×16 = 195 + 62 + 128 = 385. Известно, что M = Mr, значит M(Zn3(PO4)2) = 385 г/моль. Найдем молярную массу кристаллогидрата: ω(Zn3(PO4)2) = M(Zn3(PO4)2) / M(Zn3(PO4)2×nH2O) × 100%; M(Zn3(PO4)2×nH2O) = M(Zn3(PO4)2) × 100% /ω(Zn3(PO4)2); M(Zn3(PO4)2×nH2O) = 385 × 100% / 84,2 = 457 г/моль. Рассчитаем число молекул воды (молярная масса воды равна 18 г/моль): 457 = 385 + 18n; n = 4. Следовательно, формула кристаллогидрата фосфата цинка имеет вид Zn3(PO4)2×4H2O. |
| Ответ | Zn3(PO4)2×4H2O |











