Дисперсные системы и растворы
Дисперсные системы и их виды
Существует классификация дисперсных систем по размеру частиц дисперсной фазы. Выделяют, молекулярно-ионные (< 1 нм) – глюкоза, сахароза, коллоидные (1-100 нм) – эмульсии (масло) и суспензии (раствор глины) и грубодисперсные (>100 нм) системы.
Различают гомогенные и гетерогенные дисперсные системы. Гомогенные системы по-другому называют истинными растворами.
Растворы
По агрегатному состоянию растворы делят на газообразные (воздух), жидкие, твердые (сплавы). В жидких растворах существует понятие растворителя и растворенного вещества. В большинстве случаев растворителем служит вода, однако это могут быть и неводные растворители (этанол, гексан, хлороформ).
Способы выражения концентрации растворов
Для выражения концентрации растворов используют: массовую долю растворенного вещества (![]() , %), которая показывает, сколько граммов
растворенного вещества содержится в 100 г раствора.
, %), которая показывает, сколько граммов
растворенного вещества содержится в 100 г раствора.
![]()
Молярная концентрация (СМ, моль/л) показывает, сколько моль растворенного вещества содержится в одном литре раствора. Растворыс концентрацией 0,1 моль/л называют децимолярными, 0,01 моль/л – сантимолярными, а с концентрацией 0,001 моль/л – миллимолярными.
![]()
Нормальная концентрация (СН, моль-экв/л) показывает число эквивалентов растворенного вещества в одном литре раствора.
Моляльная концентрация (Сm, моль/1кг H2O) – число моль растворенного вещества, приходящееся на 1 кг растворителя, т.е. на 1000 г воды.
Мольная доля растворенного вещества (N) – это отношение числа моль растворенного вещества к числу моль раствора. Для газовых растворов мольная доля вещества совпадает с объемной долей ( φ).
Растворимость
По растворимости растворы и вещества делят на 3 группы: хорошо растворимые (сахар), малорастворимые (бензол, гипс) и практически нерастворимые (стекло, золото, серебро). Абсолютно нерастворимых веществ в воде нет, нет приборов, с помощью которых возможно вычислить количества вещества, которое растворилось. Растворимость зависит от температуры (рис. 1), природы вещества и давления (для газов). При повышении температуры, растворимость вещества увеличивается.
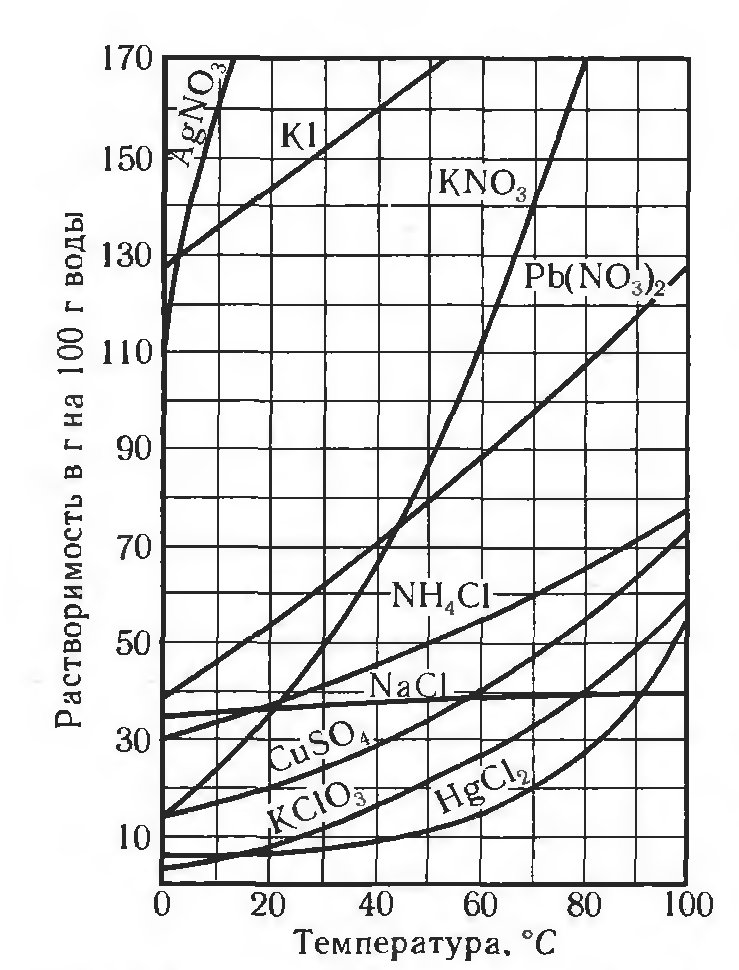
Рис. 1. Пример зависимости некоторых солей в воде от температуры
С понятием растворимости тесно связано понятие насыщенного раствора, поскольку растворимость характеризует массу растворенного вещества в насыщенном растворе. Пока вещество способно растворяться раствор называют ненасыщенным, если вещество перестает растворяться – насыщенным; на некоторое время можно создать пересыщенный раствор.
Давление пара растворов
Пар, находящийся в равновесии с жидкостью называется насыщенным. При заданной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. Поэтому каждой жидкости присуще давление насыщенного пара. Рассмотрим это явление на следующем примере: раствор неэлектролита (сахарозы) в воде – молекулы сахарозы значительно больше молекул воды. Давление насыщенного пара в растворе создает растворитель. Если сравнить между собой давление растворителя и давление растворителя над раствором при одинаковой температуре, то в растворе число молекул, перешедших в пар над раствором меньше, чем в самом растворе. Отсюда следует, что давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Если обозначить давление насыщенного пара растворителя над чистым растворителем p0, а над раствором – p, то относительное понижение давления пара над раствором будет представлять собой (p0-p)/p0.
На основании этого Ф.М. Рауль вывел закон: относительное понижение насыщенного пара растворителя над раствором равно молярной доле растворенного вещества : (p0-p)/p0 = N (молярная доля растворенного вещества).
Криоскопия. Эбулиоскопия. Второй закон Рауля
Понятия криоскопии и эбулиоскопии тесно связаны с температурами замерзания и кипения растворов, соответственно. Так, температура кипения и кристаллизация растворов зависят от давления пара над раствором. Любая жидкость кипит при той температуре, при которой давление ее насыщенного пара достигает внешнего (атмосферного давления).
При замерзании кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой равно давлению насыщенного пара над твердой фазой. Отсюда – второй закон Рауля: понижение температуры кристаллизации и повышение температуры кипения раствора пропорционально концентрациям растворенного вещества. Математическое выражение этого закона:
Δ Tкрист = K × Cm,
Δ Tкип = Е × Cm,
где К и Е криоскопическая и эбулиоскопическая константы, зависящие от природы растворителя.
Примеры решения задач
| Задание | Какое количество воды и 80%-го раствора уксусной кислоты следует взять для получения 200 г 8%-го раствора? |
| Решение | Записываем формулу для нахождения массовой доли:
Пусть масса 80% раствора уксусной кислоты равна х г. Найдем массу растворенного в нем вещества:
mр.в-ва(CH3COOH) =mр-ра × mр.в-ва(CH3COOH)1 =х × 0,8 (г) Найдем массу растворенного вещества в растворе 8%-й уксусной кислоты: mр.в-ва(CH3COOH)2 =200 (г) × 0,08 = 16 (г) mр.в-ва(CH3COOH)2 = х × 0,8 (г) = 16 (г) Найдем х: х = 16/0,8 = 20 Масса 80% раствора уксусной кислоты равна 20 (г). Найдем необходимое количество воды: m(H2O) = mр-ра2 – mр-ра1 m(H2O) = 200 (г) – 20 (г) = 180 (г) |
| Ответ | mр-ра (CH3COOH)80% = 20 (г), m(H2O) = 180 (г) |
| Задание | Смешали 200 г воды и 50 г гидроксида натрия. Определите массовую долю гидроксида натрия в растворе. |
| Решение | Записываем формулу для нахождения массовой доли:
Найдем массу раствора гидроксида натрия: mр-ра (NaOH) = m(H2O) + m(NaOH) mр-ра (NaOH) = 200 +50 = 250 (г) Найдем массовую долю гидроксида натрия:
|
| Ответ |
| Задание | Определите массу 10%-го раствора карбоната натрия, которую нужно добавить к 1020 г 2%-го раствора, чтобы получить 3%-й раствор. |
| Решение | Записываем формулу для нахождения массовой доли:
Найдем массу растворенного карбоната натрия в его 2%-м р-ре:
m(Na2CO3) в 2%-м р-ре = mр-ра(Na2СO3)2% × m(Na2CO3) в 2%-м р-ре = 1020 × 0,02 = 20,4г Пусть mр-ра(Na2CO3)10% = х (г) Найдем массу растворенного карбоната натрия в его 10%-м р-ре: m(Na2CO3) в 10%-м р-ре = 0,1х (г) Тогда масса 3%-го раствора карбоната натрия: mр-ра(Na2CO3)3% = (х + 1020) (г) А масса растворенного карбоната натрия в нем: m(Na2CO3) в 3%-м р-ре = (х + 1020) × 0,03 (г) Найдем массу растворенного карбоната натрия в конечном растворе: 20,4 + 0,1х = (х + 1020) × 0,03 х = 145,7 mр-ра(Na2CO3)10% = 145,7 (г) |
| Ответ | 145,7 (г) |











