Законы термодинамики
Начала термодинамики
Свои выводы эта наука делает на общих принципах, началах (законах термодинамики). Эти начала получены эмпирически, обобщением экспериментальных данных.
Теоретическую основу термодинамики составляют три закона.
Формулировка первого закона термодинамики
Первое начало термодинамики — это специализированная формулировка закона сохранения энергии: Подводимая к термодинамической системе теплота (Q) идет на совершение данной системой работы (A) и увеличение ее внутренней энергии (![]() ). В виде формулы первое начало запишем как:
). В виде формулы первое начало запишем как:
![]()
Выражение (1) интегральная форма первого начала термодинамики.
В дифференциальном виде первое начало термодинамики представлено как:
![]()
где ![]() — бесконечно малое количество теплоты, которое подводят к системе,
— бесконечно малое количество теплоты, которое подводят к системе, ![]() — элементарная работа, совершаемая системой,
— элементарная работа, совершаемая системой, ![]() — бесконечно малое приращение внутренней энергии термодинамической системы.
— бесконечно малое приращение внутренней энергии термодинамической системы.
Первое начало термодинамики показывает, как (насколько) изменяются термодинамические параметры, которые характеризуют систему, но не предсказывает направление развития процесса.
Формулировка второго закона термодинамики
Второе начало термодинамики имеет несколько формулировок. Приведем четыре из них.
Формулировка, которую дал В. Томсон. Не существует кругового процесса, единственным результатом которого является осуществление работы за счет охлаждения резервуара тепла. Здесь тепловым резервуаром считают систему тел, находящуюся в состоянии теплового равновесия и имеющую запас внутренней энергии. При этом считают, что сам резервуар не производит работы, он лишь передает теплоту.
Формулировка М. Планка. Невозможно сделать периодически работающую машину, действие которой заключается только в том, что она поднимает груз за счет получения теплоты от теплового резервуара, который охлаждается. Формулировка Планка отличается от формулировки Томсона только формой.
Формулировка Клаузиуса. Теплота не способна к самопроизвольному переходу от менее нагретого тела к телу с большей температурой. Под теплотой здесь понимают внутреннюю энергию. При этом имеется в виду не только тепловой контакт, а передача тепла любым способом. Надо учитывать, что невозможным считается не просто передача теплоты от тела с меньшей температурой, но такая передача без каких-либо изменений во внешних телах.
Формулировка через энтропию. Если термодинамический процесс происходит в изолированной системе, то энтропия не убывает. В математической форме второе начало термодинамики записывается как:
![Rendered by QuickLaTeX.com \[\int^{(1)}_{(2)}{\frac{\delta Q}{T}}\le 0\ или\ S_1\le S_2\left(3\right),\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3ff0662f4c6d2225b914850791787d4e_l3.png)
где ![]() — энтропия для состояний (1) и (2). Рост энтропии обозначает то, что система приближается к состоянию термодинамического равновесия.
— энтропия для состояний (1) и (2). Рост энтропии обозначает то, что система приближается к состоянию термодинамического равновесия.
Второе начало термодинамики отображает направление процесса.
Формулировка третьего начала термодинамики
Иначе третье начало термодинамики называют теоремой Нернста (по имени ученого, который ее предложил). Эту теорему можно представить в виде двух утверждений:
- Если температура системы стремится к абсолютному нулю, то ее энтропия стремится к определённому конечному пределу. Причем этот предел не зависит от того в каком равновесном состоянии находится рассматриваемая система.
- При абсолютном нуле температур переходы системы из одного равновесного состояния в другое происходят без изменения энтропии.
Другой формулировкой третьего начала термодинамики (теоремы Нернста) считают следующую:
Если температура термодинамической системы стремится к абсолютному нулю, то энтропия также стремится к нулю.
Поведение вещества около абсолютного нуля показывает справедливость теоремы Нернста. Объяснение третье начало термодинамики находит в квантовой механике.
Третье начало термодинамики имеет ряд важных следствий:
- Около абсолютного нуля температур теплоемкости всех веществ стремятся к нулю.
- Вблизи абсолютного нуля стремятся к нулю коэффициенты теплового расширения и термический коэффициент давления.
- Тело невозможно охладить до абсолютного нуля.
Примеры решения задач
| Задание | Какое количество теплоты следует сообщить газу для того, чтобы в процессе изохорного нагревания его давление изменилось на |
| Решение | Основой для решения задачи служит первое начало термодинамики:
Так как процесс, проводимый с газом, является изохорным, то: Следовательно, выражение (1.1) принимает вид: Изменение внутренней энергии газа определено как: где Для того чтобы найти изменение внутренней энергии рассматриваемого газа используем уравнение Менделеева — Клайперона. Запишем его два раза, для начального и конечного состояний процесса: Вычтем первое уравнение системы (1.4) из второго, получим: Сравним выражения (1.5) и (1.3), запишем: Подставим выражение для внутренней энергии (1.6) в формулу (1.2): |
| Ответ |
| Задание | Каково изменение энтропии (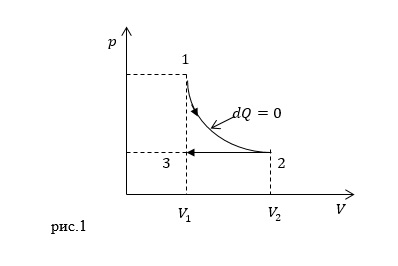
|
| Решение | Изменение энтропии в процессе 1-2-3 можно найти как сумму энтропий в процессе 1-2 и процессе 2-3:
Так как процессы в идеальном газе можно считать обратимыми, то изменение энтропии для процесса 1-2 определим как: так как процесс адиабатный проводят без теплообмена. Для процесса 2-3 имеем: где Так как процесс 2-3 является изобарным, то в соответствии с законом Гей- Люссакаи по условию задачи имеем: Окончательно изменение энтропии в заданном процессе найдем, подставив (2.3) в (2.2) и в (2.1): |
| Ответ |











