Первое начало термодинамики
Основные понятия первого начала термодинамики
В качестве основной задачи термодинамики ставят изучение свойств тел, характеризуя их состояния при помощи макроскопических параметров, при этом за основу берут общие законы, которые называют началами термодинамики. В термодинамике не пытаются выяснить микроскопические механизмы исследуемых явлений. В основе термодинамики лежат три основных закона (три начала). Первое начала термодинамики – это применение закона сохранения энергии для процессов, рассматриваемых в термодинамике. Закон сохранения энергии для теплоты (как одной из форм энергии) (![]() ), внутренней энергии (
), внутренней энергии (![]() ) и работы (A), совершаемой термодинамической системой можно интегральном виде записать как:
) и работы (A), совершаемой термодинамической системой можно интегральном виде записать как:
![]()
что означает: Количество теплоты, подводимое к термодинамической системе, идет на совершение данной системой работы и изменение ее внутренней энергии. Условлено считать, что если теплота к системе подводится, то она больше нуля (![]() ) и если работу выполняет сама термодинамическая система, то она положительна (
) и если работу выполняет сама термодинамическая система, то она положительна (![]() ).
).
Первое начало термодинамики в дифференциальном виде
Часто первое начало термодинамики используют в дифференциальном виде:
![]()
где ![]() – бесконечно малое количество теплоты, подводимое к системе;
– бесконечно малое количество теплоты, подводимое к системе; ![]() – элементарная работа системы;
– элементарная работа системы; ![]() – малое изменение внутренней энергии системы. При рассмотрении в качестве термодинамической системы идеального газа, работу, выполняемую им, связывают с изменением объема (
– малое изменение внутренней энергии системы. При рассмотрении в качестве термодинамической системы идеального газа, работу, выполняемую им, связывают с изменением объема (![]() ), поэтому выражение первого начала термодинамики представляют как:
), поэтому выражение первого начала термодинамики представляют как:
![]()
Как и в механике, закон сохранения энергии не указывает на направление процесса, происходящего в термодинамической системе. Первое начало показывает только как, изменяются параметры, если процесс в системе происходит. В механике движение описывают при помощи уравнений движения. В термодинамике направление, в котором развивается процесс, определяют при помощи второго начала.
И так, первое начало термодинамики – это выражение закона сохранения энергии для процессов, в которых участвует теплота. Работа — это передача энергии связанная с изменением макропараметров системы. Передача теплоты реализуется при помощи перехода энергии движения молекул. Изменение при этом макропараметров – это следствие изменения энергетических условий на молекулярном уровне.
Запишем первое начало термодинамики в дифференциальном виде для изопроцессов, в качестве термодинамической системы рассматривая идеальный газ. Для изобарного процесса первое начало термодинамики не изменяет своего вида (3). Для изотермического процесса первое начало примет вид:
![]()
В изотермическом процессе все тело. которое получает система идет на совершение данной системой работы.
Для изохорного процесса мы получим:
![]()
Все тепло, которое получает газ идет на изменение его внутренней энергии.
Адиабатный процесс происходит без обмена в окружающей средой теплом, следовательно:
![]()
В адиабатном процессе система совершает работу за счет уменьшения внутренней энергии.
Примеры решения задач
| Задание | Теплота подводится к одноатомному идеальному газу в изобарном процессе. Определите, какая часть количества теплоты расходуется при этом на увеличение внутренней энергии газа, а какая часть идет на совершение системой работы? |
| Решение | В соответствии и первым началом термодинамики для изобарного процесса запишем:
где работа, которую совершает идеальный газ в изобарном процессе, равна: А изменение внутренней энергии идеального газа в любом процессе, где изменяется температура равно: где i – число степеней свободы молекулы газа (так как у нас газ одноатомный, то Так как процесс происходит изобарный, то для двух состояний этого газа в процессе имеем: Из левой части выражения (1.6) вычтем левую часть (1.5), аналогично поступим с правыми частями, имеем: Первое начало термодинамики можно переписать как: |
| Ответ | На работу идет 0,4 части количества теплоты, на увеличение внутренней энергии идет 0,6 части подведенного тепла. |
| Задание | С идеальным газом проводят циклический процесс, который изображен на рис.1. Какое количество теплоты больше в данном процессе, подведенное (
Рис. 1 |
| Решение | Сделаем рисунок.
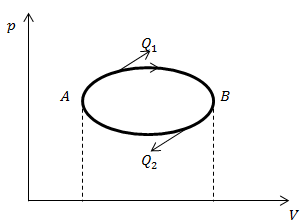
Рис. 2 Рассмотрим рис.2 В части кругового процесса (ветвь A-B) тепло к системе подводится. Соответственно на ветви В-А тепло отводится. Запишем первое начало термодинамики: Так как процесс циклический, то изменение внутренней энергии системы будет равно нулю. Следовательно, для сравнения подведенного и отведенного тепла надо сравнить работы, которые происходят в процессах А-В и В-А. По определению работа равна: Помня, что интеграл равен площади криволинейной трапеции, которою задает подынтегральное выражение, то рассмотрим площади трапеций |
| Ответ |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV\ \qquad (2.2).}\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a1309c1db893bb01f29a696e9fe2c1f2_l3.png)





