Основные законы термодинамики
Обмен энергиями сопровождает все явления в окружающем нас мире.
Данная наука является разделом молекулярной физики. Термодинамика рассматривает макроскопические свойства тел и явлений, не занимаясь молекулярным строением вещества. Но, не смотря на общие выводы, термодинамика дает возможность сделать предположения относительно течения микропроцессов.
Основные законы термодинамики
Открытие закона сохранения энергии дало начало термодинамическим исследованиям. Термодинамику считают количественной теорией тепловых процессов. Развитие техники, появление первых тепловых двигателей дало толчок для развития данной науки. Первой задачей термодинамики стало: получение оптимальных условий использования теплоты при совершении работы. Термодинамику называют описательной (феноменологической) теорией.
Для описания процессов обмена энергией в термодинамике применяют понятия и величины, смысл которых не связан с представлениями о микромире. Это так называемые макроскопические (феноменологические, термодинамические) параметры. Данные понятия имеют смысл только для макроскопических тел.
Достоинством термодинамического метода можно считать то, что термодинамические методы и соотношения не сохраняются при развитии или даже принципиальном изменении представлений о строении вещества. Общие термодинамические соотношения можно применять к веществам в любом состоянии (газам, твердым телам, жидкостям, даже электромагнитному излучению).
К недостаткам термодинамического метода можно отнести то, что для применения общих соотношений термодинамики для конкретных случаев необходима информация о свойствах вещества. Это требует опытного исследования каждого конкретного вещества.
Начала термодинамики
Основой термодинамики являются три фундаментальных закона, которые называют началами термодинамики. Они установлены, как обобщение большого числа эмпирических фактов. Выводы термодинамики имеют общий характер.
Первое начало является применением закона сохранения энергии к тепловым явлениям:
![]()
где ![]() – количество теплоты, которое получает система;
– количество теплоты, которое получает система; ![]() – изменение внутренней энергии системы;
– изменение внутренней энергии системы; ![]() – работа, которую совершает термодинамическая система. Закон сохранения энергии для теплоты в (1) записан в интегральном виде. Первое начало термодинамики означает: Количество теплоты, подводимое к термодинамической системе, расходуется на совершение этой системой работы и изменение ее внутренней энергии. Считается, что если теплота к системе подводится, то она больше нуля (
– работа, которую совершает термодинамическая система. Закон сохранения энергии для теплоты в (1) записан в интегральном виде. Первое начало термодинамики означает: Количество теплоты, подводимое к термодинамической системе, расходуется на совершение этой системой работы и изменение ее внутренней энергии. Считается, что если теплота к системе подводится, то она больше нуля (![]() ) и если работу выполняет сама термодинамическая система, то она положительна (
) и если работу выполняет сама термодинамическая система, то она положительна (![]() ).
).
В дифференциальном виде первое начало термодинамики принимает вид:
![]()
где ![]() – бесконечно малое количество теплоты, которое получает система;
– бесконечно малое количество теплоты, которое получает система; ![]() – элементарная работа, выполняемая системой;
– элементарная работа, выполняемая системой; ![]() – ее малое изменение внутренней энергии.
– ее малое изменение внутренней энергии.
Первое начала термодинамики ни как не указывает на направление развития процесса. Для этого существует второе начало. Оно определяет направление развития процессов, исследуемых термодинамикой. Согласно данному началу теплота не может целиком превращаться в работу. Формулировок второго начала термодинамики несколько. Приведем одну из них:
В любом процессе, который происходит в замкнутой системе, энтропия не убывает. В виде формулы второй закон термодинамики можно представить как:
![Rendered by QuickLaTeX.com \[\int^{\left(1\right)}_{(2), L}{\frac{\delta Q}{T}=\int^{(1)}_{(2)}{dS}}=S_1-S_2\le 0 \qquad (3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9cbde66107b08009d89a01cca7dfc6f0_l3.png)
где ![]() – энтропия;
– энтропия; ![]() – путь, по которому система переходит из одного состояния в другое. Данная формулировка второго начала термодинамики базируется на определении энтропии как функции состояния термодинамической системы.
– путь, по которому система переходит из одного состояния в другое. Данная формулировка второго начала термодинамики базируется на определении энтропии как функции состояния термодинамической системы.
Энтропией называют функцию состояния термодинамической системы, элемент которой в обратимом процессе равен:
![]()
В соответствии со вторым началом термодинамики в необратимом элементарном процессе изменение энтропии:
![]()
При помощи третьего начала накладываются ограничения на процессы, утверждается неосуществимость процессов, которые бы вели к достижению термодинамического нуля температуры. Третье начало термодинамики носит название теоремы Нернста. Смысл данной теоремы можно свети к двум утверждениям:
- если температура термодинамической системы приближается к абсолютному нулю, то энтропия системы стремится к определённому конечному пределу;
- все процессы при
 при переходе системы из одного состояния равновесия в другое происходят без изменения энтропии.
при переходе системы из одного состояния равновесия в другое происходят без изменения энтропии.
Теорему Нернста можно сформулировать так: При температуре системы стремящейся к нулю энтропия стремится к нулю, и это не зависит от значений других параметров термодинамической системы.
Все термодинамические законы относятся к телам, количество молекул которых очень велико (макроскопические тела).
Примеры решения задач
| Задание | Какое количество теплоты следует сообщить идеальному газу объемом |
| Решение | В качестве основы для решения задачи будем считать первое начало термодинамики в интегральном виде:
Так как по условию задачи проводят изохорный процесс, то работа в таком процессе равна нулю, следовательно, первое начало термодинамики преобразуется к виду: Изменение внутренней энергии идеального газа найдем, используя формулу: Состояние идеального газа можно описывать при помощи уравнения Менделеева – Клапейрона: Записывая уравнение (1.4) для начального и конечного состояний газа в проводимом процессе, найдем изменение температуры ( Используя формулы (1.2), (1.3) и (1.5), получим: |
| Ответ |
| Задание | Какое количество теплоты было подведено к идеальному газу в процессе, который представлен на рис.1, если работа газа в нем равна A? Число степеней свободы молекулы газа считайте равным 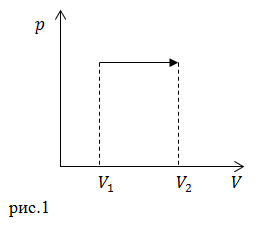
|
| Решение | В качестве основы для решения задачи будем считать первое начало термодинамики в интегральном виде:
Изменение внутренней энергии идеального газа не зависит от процесса. Оно равно: Работа по определению: На рис.1 изображен изобарный процесс, следовательно: Состояние идеального газа опишем при помощи уравнения Менделеева – Клапейрона: Запишем уравнение (2.5) для начального и конечного состояний газа в нашем процессе, найдем величину ( Сравнивая выражения (2.2) и (2.6) получаем: Подставим (2.7) в первое начало термодинамики (2.1), количество теплоты, подведенное в процессе равно: |
| Ответ |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (2.3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b80269a9b2726978abb60107bf3f0e9c_l3.png)





