Основные понятия термодинамики
Термодинамика является теорией тепловых явлений, которая не учитывает молекулярное строение вещества. Термодинамику называют описательной (феноменологической) теорией.
Основные понятия термодинамики
Для описания свойств термодинамических систем применяют переменные, которые называются термодинамическими параметрами (![]() — давление;
— давление; ![]() – объем;
– объем; ![]() – термодинамическая температура;
– термодинамическая температура; ![]() – плотность,
– плотность, ![]() – удельная теплоемкость и т.д.). Термодинамическими параметрами являются физические величины, используя которые описывают явления, связанные с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул. Так, нельзя говорить, например, о температуре одной молекулы или плотности вещества, состоящего из 10 молекул.
– удельная теплоемкость и т.д.). Термодинамическими параметрами являются физические величины, используя которые описывают явления, связанные с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул. Так, нельзя говорить, например, о температуре одной молекулы или плотности вещества, состоящего из 10 молекул.
Параметры делятся на внутренние и внешние. Внешними называются параметры, фиксирующие внешние условия для термодинамической системы. Внутренними называют параметры, устанавливающиеся в системе как результат фиксации внешних условий. Один и тот же параметр может выступать в роли внешнего и внутреннего.
Основой термодинамики служат три основных закона, которые называют началами термодинамики.
Тепловые процессы – это процессы передачи и превращения энергии. Основные термодинамические законы отражают поведение энергии.
Модель, которую применяют в термодинамике – это модель идеального газа. С ее помощью исследуют термодинамические процессы.
Количество теплоты
В процессах теплообмена термодинамическая система получает или отдает теплоту (![]() ). Теплота – это энергия в специфической форме – форме молекулярного движения. Количество теплоты, которое получает тело массы
). Теплота – это энергия в специфической форме – форме молекулярного движения. Количество теплоты, которое получает тело массы ![]() при увеличении его температуры на величину равную
при увеличении его температуры на величину равную ![]() (oC), равно:
(oC), равно:
![]()
где ![]() – удельная теплоемкость вещества. Теплоемкость тела (C) определяют как:
– удельная теплоемкость вещества. Теплоемкость тела (C) определяют как:
![]()
где ![]() – элементарное количество теплоты.
– элементарное количество теплоты.
Считают, что ![]() , если теплота сообщается системе.
, если теплота сообщается системе.
Внутренняя энергия
Внутренней энергией называют энергию, которая связана со всеми возможными движениями и взаимодействиями частиц, составляющих термодинамическую систему. К внутренней энергии не относят кинетическую энергию, связанную с движением центра масс системы и потенциальную энергию системы во внешних полях. Обозначают внутреннюю энергию в термодинамике буквой ![]() . При этом
. При этом ![]() — бесконечно малое изменения внутренней энергии.
— бесконечно малое изменения внутренней энергии. ![]() , если внутренняя энергия системы растет.
, если внутренняя энергия системы растет.
Для идеального газа внутреннюю энергию можно вычислить при помощи формулы:
![]()
где ![]() – число степеней свободы молекулы;
– число степеней свободы молекулы; ![]() – масса;
– масса; ![]() – молярная масса;
– молярная масса; ![]() – универсальная газовая постоянная; T – температура по термодинамической шкале.
– универсальная газовая постоянная; T – температура по термодинамической шкале.
Работа в термодинамике
Работу в термодинамике определяют как:
![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (4)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-56eaf8a26194ff41ba23ae3fdd4fb35b_l3.png)
где ![]() – начальный объем системы;
– начальный объем системы; ![]() – конечный объем. Работа считается большей нуля, если работу выполняет термодинамическая система над внешними силами.
– конечный объем. Работа считается большей нуля, если работу выполняет термодинамическая система над внешними силами.
Энтропия
Энтропия (![]() ) – это функция состояния, в обратимом процессе дифференциалом которой является величина
) – это функция состояния, в обратимом процессе дифференциалом которой является величина ![]() :
:
![]()
где ![]() – количество теплоты, полученное термодинамической системой в ходе обратимого процесса;
– количество теплоты, полученное термодинамической системой в ходе обратимого процесса; ![]() – термодинамическая температура системы.
– термодинамическая температура системы.
В любом обратимом круговом процессе энтропия не изменяется:
![]()
Энтропия системы, которая совершает необратимый цикл, увеличивается:
![]()
Выражения (6) и (7) справедливы только для замкнутых систем. Если мы имеем дело с открытой термодинамической системой, то энтропия может вести себя как угодно.
Начала термодинамики
Первое начало – это применение закона сохранения энергии к термодинамическим процессам:
![]()
Формула (8) означает, что количество теплоты, подводимое к термодинамической системе, расходуется на совершение этой системой работы и изменение ее внутренней энергии.
Иногда первое начало термодинамики удобно использовать в дифференциальном виде:
![]()
где ![]() – бесконечно малое количество теплоты, которое получает система;
– бесконечно малое количество теплоты, которое получает система; ![]() – элементарная работа, выполняемая системой;
– элементарная работа, выполняемая системой; ![]() – ее малое изменение внутренней энергии.
– ее малое изменение внутренней энергии.
Второе начало определяет направление развития процессов, исследуемых термодинамикой. Согласно данному началу теплота не может полностью превращаться в работу. Формулировок второго начала термодинамики несколько. Приведем одну из них:
В любом процессе, который происходит в замкнутой системе, энтропия не убывает. В математическом виде второй закон термодинамики можно представить как:
![Rendered by QuickLaTeX.com \[\int^{(1)}_{(2), L}{\frac{\delta Q}{T}}=\int^{(1)}_{(2)}{dS}}=S_1-S_2\le 0 \qquad (10)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-088d2610321bb2b044c4a6bcbaf990c9_l3.png)
где ![]() – энтропия;
– энтропия; ![]() – путь, по которому система переходит из одного состояния в другое.
– путь, по которому система переходит из одного состояния в другое.
Третье начало термодинамики накладывает ограничения на процессы. Оно утверждает неосуществимость процессов, которые бы вели к достижению термодинамического нуля температуры.
Коэффициент полезного действия в термодинамике
Коэффициентом полезного действия (КПД) (![]() ) в термодинамике называют отношение работы (
) в термодинамике называют отношение работы (![]() ), которое совершает рабочее тело к количеству теплоты (
), которое совершает рабочее тело к количеству теплоты (![]() ), которое получило это тело:
), которое получило это тело:
![]()
где ![]() — количество теплоты, которое рабочее тело отдает холодильнику.
— количество теплоты, которое рабочее тело отдает холодильнику.
Для цикла Карно (рабочим телом является идеальный газ), который состоит из двух изотерм и двух адиабат КПД можно вычислить как:
![]()
где ![]() – температура нагревателя;
– температура нагревателя; ![]() – температура холодильника.
– температура холодильника.
Примеры решения задач
| Задание | При адиабатном расширении |
| Решение | Для идеального газа изменение внутренней энергии найдем как:
где По условию газ совершает адиабатное расширение, уравнение адиабатного процесса запишем как: где показатель адиабаты Подставим найденную температуру |
| Ответ |
| Задание | Идеальный газ выполняет цикл Карно. КПД цикла при этом равен |
| Решение | Сделаем рисунок.
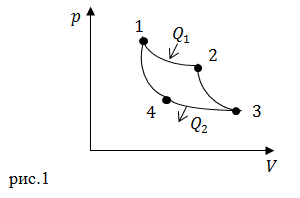
Изотермическим расширением является процесс 1-2 на рис.1. Изотермическим сжатием процесс 3-4. Тепло к идеальному газу подводится в процессе 1-2, в процессе 3-4 отводится. КПД цикла можно найти как: При этом работу A найдем как: Выразим работу изотермического сжатия из (2.2): |
| Ответ |






![Rendered by QuickLaTeX.com \[\Delta U=\frac{i}{2}\nu RT_1\left({\left(\frac{V_1}{V_2}\right)}^{\gamma -1}-1\right)=\frac{i}{2}\nu RT_1(n^{1-\gamma }-1)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ada7e7f470ed8b0fe36f2b2834fb559d_l3.png)





