Первый закон термодинамики
Существует две формы передачи энергии от одних тел к другим — это совершение работы одних тел над другими и передача теплоты. Энергия механического движения может переходить в энергию теплового движения и наоборот. В таких переходах энергии выполняется закон сохранения энергии. В применении к процессам, рассматриваемым в термодинамике, закон сохранения энергии именуется первым законом (или первым началом) термодинамики. Этот закон является обобщением эмпирических данных.
Формулировка первого закона термодинамики
Первый закон термодинамики формулируют следующим образом:
Количество теплоты, которое подводится к системе, расходуется на совершение данной системой работы (против внешних сил) и изменение ее внутренней энергии. В математическом виде первый закон термодинамики можно записать в интегральном виде:
![]()
где ![]() – количество теплоты, которое получает термодинамическая система;
– количество теплоты, которое получает термодинамическая система; ![]() – изменение внутренней энергии рассматриваемой системы; A – работа, которую выполняет система над внешними телами (против внешних сил).
– изменение внутренней энергии рассматриваемой системы; A – работа, которую выполняет система над внешними телами (против внешних сил).
В дифференциальном виде первый закон термодинамики записывают как:
![]()
где ![]() – элемент количества теплоты, который получает система;
– элемент количества теплоты, который получает система; ![]() – бесконечно малая работа, которую выполняет термодинамическая система;
– бесконечно малая работа, которую выполняет термодинамическая система; ![]() – элементарное изменение внутренней энергии, рассматриваемой системы. Следует обратить внимание на то, что в формуле (2)
– элементарное изменение внутренней энергии, рассматриваемой системы. Следует обратить внимание на то, что в формуле (2) ![]() – элементарное изменение внутренней энергии является полным дифференциалом, в отличие от
– элементарное изменение внутренней энергии является полным дифференциалом, в отличие от ![]() и
и ![]() .
.
Количество теплоты считают положительным, если система тепло получает и отрицательным, если тепло отводится от термодинамической системы. Работа будет больше нуля, если ее совершает система, и работа будет считаться отрицательной, если она совершается над системой внешними силами.
В то случае, если система вернулась в первоначальное состояние, то изменение ее внутренней энергии будет равно нулю:
![]()
В таком случае в соответствии с первым законом термодинамики мы имеем:
![]()
Выражение (4) означает, что невозможен вечный двигатель первого рода. То есть, принципиально нельзя создать периодически действующую систему (тепловой двигатель), совершающую работу, которая была бы больше, чем количество теплоты, полученное системой извне. Положение о невозможности вечного двигателя первого рода, также является одним из вариантов формулировки первого закона термодинамики.
Примеры решения задач
| Задание | Какое количество теплоты ( |
| Решение | Основой для решения задачи является первый закон термодинамики, который мы будем использовать в интегральном виде:
Так как по условию задачи процесс с газом проводят изохорный ( Изменение внутренней энергии определяют при помощи формулы: где i – число степеней свободы молекулы газа; Выразим из (1.4) температуру, запишем формулы для двух состояний рассматриваемой системы: Используя выражения (1.5) найдем Из выражений (1.3) и (1.6) следует, что для изохорного процесса изменение внутренней энергии можно найти как: А из первого начала термодинамики для нашего процесса (при |
| Ответ |
| Задание | Найдите изменение внутренней энергии кислорода (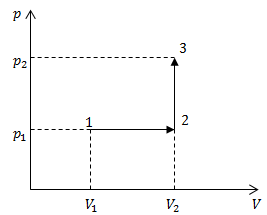
Рис. 1 |
| Решение | Изменение внутренней энергии не зависит от хода процесса, так как внутренняя энергия является функцией состояния. Она зависит только от конечного и начального состояний системы. Поэтому можно записать, что изменение внутренней энергии в процессе 1-2-3, равно:
где i – число степеней свободы молекулы кислорода (так как молекула состоит из двух атомов, то считаем Используя формулу (2.2) преобразуем выражение (2.1) к виду: Проведем вычисления изменения внутренней энергии: Перейдем к нахождению работы, которую совершает газ в процессе 1-2-3. Посмотрим на рис.1. Процесс 2-3 происходит при постоянном объёме (является изохорным), следовательно, в этом процессе работа будет равна нулю. Процесс 1-2 протекает при постоянном давлении, значит, работу найдет как: Можем приступать к вычислению работы в процессе 1-2-3 (учтем, что Используя первое начало термодинамики в интегральном виде: Вычислим количество теплоты, которое получил кислород в процессе (1-2-3), который представлен на рис.1: |
| Ответ |











