Второй закон термодинамики
Как известно, первое начало термодинамики отображает закон сохранения энергии в термодинамических процессах, однако оно не дает представление о направлении протекания процессов. Помимо этого можно придумать множество термодинамических процессов, которые не будут противоречить первому началу, но в реальной действительности таких процессов не существует. Существование второго закона (начала) термодинамики вызвано необходимостью установить возможность того или иного процесса. Этот закон определяет направление течения термодинамических процессов. При формулировке второго начала термодинамики используют понятия энтропии и неравенство Клаузиуса. В таком случае второй закон термодинамики формулируется как закон роста энтропии замкнутой системы, если процесс является необратимым.
Формулировки второго закона термодинамики
Если в замкнутой системе происходит процесс, то энтропия этой системы не убывает. В виде формулы второй закон термодинамики записывают как:
![Rendered by QuickLaTeX.com \[\int^{(1)}_{(2)\ L}{\frac{\delta Q}{T}=\int^{(1)}_{(2)}{dS}}=S_1-S_2\le 0 \qquad (1),\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d2a9866abe0aa1440cc8e9ce38fbd77a_l3.png)
где S – энтропия; L – путь по которому система переходит из одного состояния в другое.
В данной формулировке второго начала термодинамики следует обратить внимание на то, что рассматриваемая система должна быть замкнутой. В незамкнутой системе энтропия может вести себя как угодно (и убывать, и возрастать, и оставаться постоянной). Заметим, что энтропия не изменяется в замкнутой системе при обратимых процессах.
Рост энтропии в замкнутой системе при необратимых процессах — это переход термодинамической системы из состояний с меньшей вероятностью в состояния с большей вероятностью. Известная формула Больцмана дает статистическое толкование второго закона термодинамики:
![]()
где k – постоянная Больцмана; w – термодинамическая вероятность (количество способов при помощи которых, может реализовываться рассматриваемое макросостояние системы). Так, второй закон термодинамики является статистическим законом, который связан с описанием закономерностей теплового (хаотического) движения молекул, которые составляют термодинамическую систему.
Другие формулировки второго закона термодинамики
Существует ряд других формулировок второго закона термодинамики:
1) Формулировка Кельвина: Невозможно создать круговой процесс, результатом которого станет исключительно превращение теплоты, которое получено от нагревателя, в работу. Из данной формулировки второго закона термодинамики делают вывод о невозможности создания вечного двигателя второго рода. Это означает, что периодически действующая тепловая машина должна иметь нагреватель, рабочее тело и холодильник. При этом КПД идеальной тепловой машины не может быть больше, чем КПД цикла Карно:
![]()
где ![]() – температура нагревателя;
– температура нагревателя; ![]() — температура холодильника; (
— температура холодильника; (![]() ).
).
2) Формулировка Клаузиуса: Невозможно создать круговой процесс в результате которого будет происходить исключительно передача тепла от тела с меньшей температурой к телу с большей температурой.
Второй закон термодинамики отмечает существенное различие между двумя формами передачи энергии (работой и теплотой). Из этого закона следует, переход упорядоченного перемещение тела, как единого целого в хаотическое движение молекул тела и внешней среды – является необратимым процессом. При этом упорядоченное движение может переходить в хаотическое без дополнительных (компенсационных) процессов. Тогда как переход неупорядоченного движения в упорядоченное должен сопровождаться компенсирующим процессом.
Примеры решения задач
| Задание | В чем состоит суть проблемы «Тепловой смерти Вселенной»? Почему эта проблема является несостоятельной?< |
| Решение | Данная проблема была сформулирована в XIX веке. Если считать Вселенную замкнутой системой и пытаться применить к ней второй закон термодинамики, то по гипотезе Клаузиуса энтропия Вселенной достигнет некоторого максимума. То есть через некоторое время все формы движения станут тепловым движением. Вся теплота от тел с более высокой температурой перейдет к телам, имеющим более низкую температуру, то есть температуры всех тел Вселенной станут равны. Вселенная придет в состояние теплового равновесия, все процессы прекратятся — это называют тепловой смертью Вселенной. Ошибка данного положения о тепловой смерти Вселенной заключена в том, что второй закон термодинамики неприменим к незамкнутым системам, а Вселенную считать замкнутой не следует. Так как она является безграничной и состоит в бесконечном развитии. |
| Задание | Чему равно КПД цикла, который представлен на рис.1? Считайте, что в процессе участвует идеальный газ (число степеней свободы равно i) и его объем изменяется в n раз.
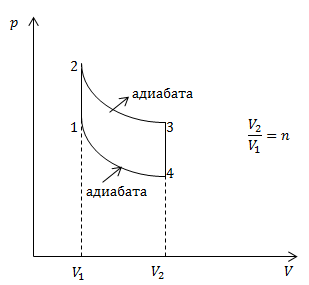
Рис. 1 |
| Решение | Коэффициент полезного действия цикла, который представлен на рис.1 найдем как:
где Используя первое начало термодинамики, найдем количество тепла, полученное газом в процессе 1-2, который является изохорным: По аналогии для изохорного процесса, в котором теплота отводится, имеем: Подставим полученный результат (2.2 – 2.5) в выражение (2.1): Используем уравнение адиабаты для нахождения разностей температур, и рассматривая рис.1. Для процесса 2-3 запишем: Аналогично описываем процесс 4-1: Используя выражения (2.7) и (2.8) найдем разность Из формулы (2.9) получим, что: где |
| Ответ |






![Rendered by QuickLaTeX.com \[\eta =\frac{\frac{i}{2}{\mathbf \nu }R\left(T_2-T_1\right)+\frac{i}{2}{\mathbf \nu }R\left(T_4-T_3\right)}{\frac{i}{2}{\mathbf \nu }R\left(T_2-T_1\right)}=\frac{T_2-T_1+T_4-T_3}{T_2-T_1}=1-\frac{T_3-T_4}{T_2-T_1} \qquad (2.6)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-81d54412f271eba17871a29266586645_l3.png)
![Rendered by QuickLaTeX.com \[T_2V^{\gamma -1}_1=T_3V^{\gamma -1}_2\to T_2=T_3\left(\frac{V^{\gamma -1}_2}{V^{\gamma -1}_1}\right)=T_3n^{\gamma -1}\ \qquad (2.7)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f993ed4fa2e370d99e1048f0676ae403_l3.png)
![Rendered by QuickLaTeX.com \[T_1V^{\gamma -1}_1=T_4V^{\gamma -1}_2\to T_1=T_4\left(\frac{V^{\gamma -1}_2}{V^{\gamma -1}_1}\right)=T_4n^{\gamma -1}\ \qquad (2.8)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a2f536b86f857bacc46e5b61d238b404_l3.png)





