Основы термодинамики
Основы термодинамики
Данная наука является разделом молекулярной физики. Термодинамика рассматривает макроскопические свойства тел и явлений, не занимаясь молекулярным строением вещества.
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя их, описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул, например, таковыми являются температура, плотность вещества и т.д.
Базу термодинамики составляют три основных закона, или как их называют начала термодинамики.
Первое начало термодинамики
Первое начало термодинамики говорит о том, что теплота, получаемая термодинамической системой (![]() ), расходуется ей на совершение работы (
), расходуется ей на совершение работы (![]() ) и изменение ее внутренней энергии (
) и изменение ее внутренней энергии (![]() ):
):
![]()
Выражение (1) носит название интегральной формы первого начала термодинамики. Работу в термодинамике находят как:
![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (2)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-307146ee2b5ca3587ed0509196a22027_l3.png)
где ![]() – начальный объем системы;
– начальный объем системы; ![]() – конечный объем.
– конечный объем. ![]() если работу выполняет система (газ) над внешними силами.
если работу выполняет система (газ) над внешними силами.
В дифференциальном виде первый закон термодинамики записывают как:
![]()
или:
![]()
где ![]() – давление;
– давление; ![]() – элементарное изменение объема;
– элементарное изменение объема; ![]() – теплоемкость тела.
– теплоемкость тела.
Тело имеет внутреннюю энергию (![]() ). Для идеального газа внутренняя энергия вычисляется как:
). Для идеального газа внутренняя энергия вычисляется как:
![]()
где ![]() – число степеней свободы молекулы;
– число степеней свободы молекулы; ![]() – масса;
– масса; ![]() – молярная масса;
– молярная масса; ![]() – универсальная газовая постоянная; T – температура по абсолютной шкале.
– универсальная газовая постоянная; T – температура по абсолютной шкале.
Существование внутренней энергии макросистемы (![]() ), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
Энтропия (![]() ) – это функция состояния термодинамической системы, в обратимом процессе:
) – это функция состояния термодинамической системы, в обратимом процессе:
![]()
В соответствии со вторым началом термодинамики в необратимом элементарном процессе изменение энтропии:
![]()
Для адиабатного процесса выражение (7) имеет вид:
![]()
где знак равно относится к обратимому процессу. Выражение (8) – математическая запись второго начала термодинамики (Следует помнить, что рассматривается замкнутая система).
При помощи третьего начала накладываются ограничения на процессы, утверждается неосуществимость процессов, которые бы вели к достижению термодинамического нуля температуры. Этот закон термодинамики называют теоремой Нернста. Ее можно сформулировать так: При температуре системы стремящейся к нулю энтропия стремится к нулю, и это не зависит от значений других параметров термодинамической системы.
Все термодинамические законы относятся к телам, количество молекул которых очень велико (макроскопические тела).
Примеры решения задач
| Задание | Идеальный газ при давлении 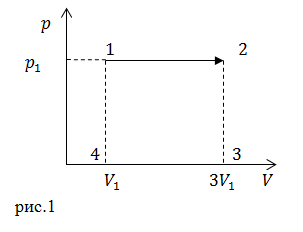
|
| Решение | По определению работа в термодинамике равна:
Следовательно, ее можно найти как площадь прямоугольника 1234: Вычислим работу газа: |
| Ответ |
| Задание | В закрытом сосуде находится смесь из двух газов масса одного |
| Решение | Если считать газы в нашей задаче идеальными, то изменение внутренней энергии равно:
где Получим, что: |
| Ответ |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4a55b6eaf9abcba5e3d6953724d4712b_l3.png)





