Формулы термодинамики
Определение и формулы термодинамики
При этом считается, что любое тело имеет внутреннюю энергию (U), которая зависит от его температуры:
![]()
где i – число степеней свободы молекулы; m – масса; ![]() – молярная масса;
– молярная масса; ![]() – универсальная газовая постоянная; T – температура по абсолютной шкале.
– универсальная газовая постоянная; T – температура по абсолютной шкале.
При теплообмене количество теплоты (Q) служит мерой изменения внутренней энергии. Количество теплоты, которое получает тело массы m при увеличении его температуры на величину равную ![]() , равно:
, равно:
![]()
где ![]() – удельная теплоемкость вещества. В общем случае теплоемкость тела (C) определена как:
– удельная теплоемкость вещества. В общем случае теплоемкость тела (C) определена как:
![]()
В соответствии с первым началом термодинамики, теплота, которую получает термодинамическая система (![]() ), расходуется ей на совершение работы (A) и изменение ее внутренней энергии (
), расходуется ей на совершение работы (A) и изменение ее внутренней энергии (![]() ):
):
![]()
Для элементарного изменения состояния термодинамической системы первый закон термодинамики записывают как:
![]()
или:
![]()
где p – давление; ![]() – элементарное изменение объема.
– элементарное изменение объема.
Термодинамическим коэффициентом полезного действия (КПД) (![]() ) называют отношение работы (A), которое совершает рабочее тело к количеству теплоты (
) называют отношение работы (A), которое совершает рабочее тело к количеству теплоты (![]() ), которое получает данное тело:
), которое получает данное тело:
![]()
где ![]() — количество теплоты, отданное рабочим телом холодильнику.
— количество теплоты, отданное рабочим телом холодильнику.
Для цикла Карно, который состоит из двух изотерм и двух адиабат и проводится с идеальным газом КПД равно:
![]()
где ![]() – температура нагревателя;
– температура нагревателя; ![]() – температура холодильника.
– температура холодильника.
Энтропия в термодинамике
Энтропией называют функцию состояния термодинамической системы, элемент которой в обратимом процессе равен:
![]()
В соответствии со вторым началом термодинамики в необратимом элементарном процессе изменение энтропии:
![]()
Для адиабатного процесса выражение (10) имеет вид:
![]()
где знак равно относится к обратимому процессу. Выражение (11) – математическая запись второго начала термодинамики (Следует помнить, что рассматривается замкнутая система).
Работа в термодинамике вычисляется как:
![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (12)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5e1f7d464f528b11c2eb2c13a27fa716_l3.png)
где ![]() – начальный объем системы;
– начальный объем системы; ![]() – конечный объем. Работа считается большей нуля, если работу выполняет система (газ) над внешними силами.
– конечный объем. Работа считается большей нуля, если работу выполняет система (газ) над внешними силами.
Примеры решения задач по теме «Термодинамика»
| Задание | Дайте характеристики простейших изо процессов для идеального газа, приведите законы связывающие параметры их состояний, запишите первое начало термодинамики применительно к данным процессам. |
| Решение | 1) Изохорный процесс: Работа в изохорном процессе равна нулю ( Работа в изобарном процессе равна: Первое начало термодинамики для изобарного процесса: Работа в изотермическом процессе равна: Изменение внутренней энергии в изотермическом процессе равно нулю, поэтому первое начало термодинамики для него представлено формулой: |
| Задание | На рис. 1 заданы два циклических процесса. Найдите отношения работ (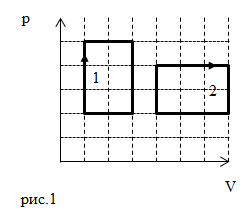
|
| Решение | По определению работа газа в термодинамике равна:
Исходя из свойства интеграла, получим, что работа – равна площади криволинейной трапеции, которая задана подынтегральным выражением. Но, следует учесть, что в круговом процессе работу выполняет газ и работа выполняется над газом, когда его объем уменьшают от максимального (в рассматриваемом процессе) до первоначального. Получается, что результирующая работа, выполняемая газом в круговом процессе, равна площади фигуры, которая ограничена замкнутой кривой цикла, если цикли представлен в осях |
| Ответ | |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (2.1)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5d8d44e891e9f14c29707d1f86157c90_l3.png)





