Законы Фарадея
Законы электролиза
При прохождении электрического тока через электролиты происходит процесс разложения вещества, который называют электролизом. При этом проводники, которые погружены в раствор, называют анодом (положительный электрод) и катодом (отрицательный электрод).
При помощи электролиза получают различные вещества, например, хлор, фтор, щелочи и т.д. При помощи данного процесса производят переработку сырья, которое содержит металлы, очищают металлы. Используя процессы электролиза, наносят тонкие металлические покрытия на разные металлические поверхности.
Формулировка первого закона Фарадея
Масса вещества, которое выделяется на электроде, прямо пропорциональна заряду, который прошел через электролит. В виде формулы данный закон можно представить как:
![]()
где ![]() — полный заряд, который проходит через электролит, за времяt.
— полный заряд, который проходит через электролит, за времяt. ![]() — сила тока.
— сила тока. ![]() — коэффициент пропорциональности (электрохимический эквивалент вещества (
— коэффициент пропорциональности (электрохимический эквивалент вещества (![]() )), равный массе вещества, которая выделится при прохождении через электролит заряда равного 1 Кл. Величина
)), равный массе вещества, которая выделится при прохождении через электролит заряда равного 1 Кл. Величина ![]() является характеристикой вещества.
является характеристикой вещества.
Первый закон для электролиза был получен Фарадеем экспериментально.
Формулировка второго закона Фарадея
Электрохимический эквивалент пропорционален молярной массе вещества (![]() ) и обратно пропорционален величине его химической валентности (
) и обратно пропорционален величине его химической валентности (![]() ). В математическом виде второй закон Фарадея записывают как:
). В математическом виде второй закон Фарадея записывают как:
![]()
где ![]() Кл/моль — постоянная Фарадея, полученная эмпирически. Величину
Кл/моль — постоянная Фарадея, полученная эмпирически. Величину ![]() называют химическим эквивалентом вещества, она показывает, какая масса вещества требуется для замещения одного моля водорода в химических соединениях.
называют химическим эквивалентом вещества, она показывает, какая масса вещества требуется для замещения одного моля водорода в химических соединениях.
Иногда второй закон Фарадея формулируют так:
Электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
Второй закон Фарадея также относят к эмпирическим законам.
Объединенный закон Фарадея для электролиза
Объединенный закон Фарадея записывают в виде:
![]()
Физический смысл выражения (3) заключен в том, что постоянная Фарадея количественно равна заряду, который следует пропустить через всякий электролит для того, чтобы на электродах выделилось вещество в количестве, равном одному химическому эквиваленту.
Примеры решения задач
| Задание | Электрохимический эквивалент водорода |
| Решение | Для решения задачи используем второй закон Фарадея:
Для водорода выражение (1.1) запишем как: для хлора формула (1.1) будет иметь вид: Приравняем правые части выражений (1.2) и (1.3), получим: Вычислим искомый эквивалент: |
| Ответ |
| Задание | Какова толщина слоя меди, которая выделится на катоде при электролизе раствора |
| Решение | В соответствии с объединенным законом Фарадея запишем:
где Силу тока можно рассчитать как: 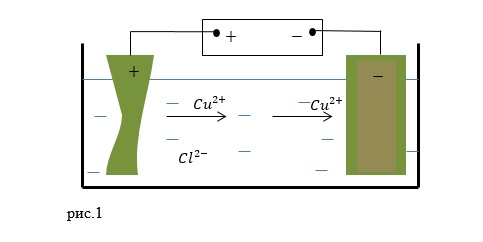
Перепишем закон Фарадея в виде: Так как: где Приравняем правые части выражений (2.3) и (2.4), выразим искомую толщину: |
| Ответ |











