Законы идеальных газов
Эти материальные точки взаимодействуют между собой и со стенками сосуда, в котором находятся, только при столкновениях, по законам абсолютно упругого соударения шаров. Данная модель является полезной для приближенного описания систем, состоящих из большого количества частиц. Большинство законов молекулярно-кинетической теории газов были созданы при ее использовании.
Уравнение связи давления газа и средней кинетической энергии поступательного движения молекул
Давление (p) идеального газа равно:
![]()
где ![]() — средняя кинетическая энергия поступательного движения молекул газа;
— средняя кинетическая энергия поступательного движения молекул газа; ![]() — концентрация молекул газа (N – число молекул газа в сосуде; V – объем сосуда). Уравнение (1) показывает, что газ совершает давление на стенки сосуда так, как его молекулы перемещаясь, ударяют о стенки сосуда и взаимодействуют со стенками, как упругие тела по законам классической механики.
— концентрация молекул газа (N – число молекул газа в сосуде; V – объем сосуда). Уравнение (1) показывает, что газ совершает давление на стенки сосуда так, как его молекулы перемещаясь, ударяют о стенки сосуда и взаимодействуют со стенками, как упругие тела по законам классической механики.
Уравнение состояния идеального газа
Уравнением состояния идеального газа (или уравнением Клапейрона — Менделеева) называют выражение, которое связывает три основных параметра (![]() ), при помощи которых, описывают состояние массы определенного газа, как термодинамической системы:
), при помощи которых, описывают состояние массы определенного газа, как термодинамической системы:
![]()
где ![]() — молярная масса газа;
— молярная масса газа; ![]() – универсальная газовая постоянная; m – масса газа; V – объем газа;
– универсальная газовая постоянная; m – масса газа; V – объем газа; ![]() – температура по абсолютной шкале температур.
– температура по абсолютной шкале температур.
Процессы в идеальном газе
Изо процессами называют процессы, которые происходят в постоянной массе идеального газа при одном фиксированном термодинамическом параметре T,V или p.
Закон Бойля – Мариотта. Для постоянной массы (m) идеального газа при постоянной температуре (T) произведение давления (p) газа на его объем (V) является постоянной величиной для любых состояний рассматриваемого вещества:
![]()
Такой процесс называют изотермическим. Изо процессы, протекающие в газе, часто изображают графически. Так для изотермического процесса, мы имеем графики, которые изображены на рис.1.
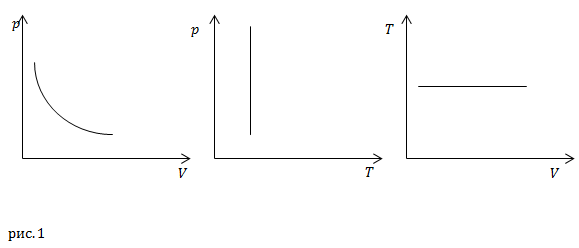
Линии на графиках, изображающие изотермический процесс, называют изотермами.
Закон Гей-Люссака. Для постоянной массы газа при неизменном давлении выполняется соотношение:
![]()
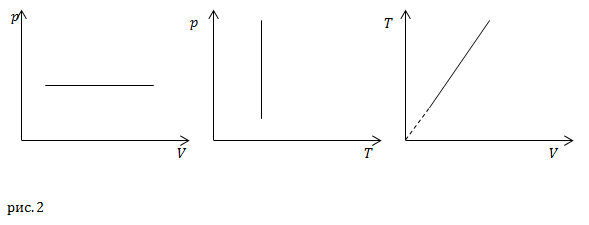
Процесс в постоянной массе газа, проводимый при неизменном давлении называют изобарическим. На рис. 2 изображены изобары.
Закон Шарля. Для постоянной массы газа, при постоянном объеме, отношение давления газа к температуре, не изменяется:
![]()
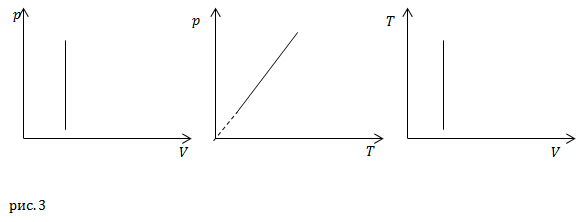
Данный процесс называют изохорическим (изохорным). Линии на графиках – изохоры.
Адиабатный процесс
Адиабатным процессом называется процесс, проводимый в газе без теплообмена с окружающей средой (![]() ). Равенство, которое связывает параметры системы в этом процессе, носит название уравнения Пуассона:
). Равенство, которое связывает параметры системы в этом процессе, носит название уравнения Пуассона:
![]()
где ![]() – показатель адиабаты; i – число степеней свободы молекулы идеального газа.
– показатель адиабаты; i – число степеней свободы молекулы идеального газа.
Примеры решения задач
| Задание | Найдите отношение плотности метана к плотности кислорода, если газы находятся при одинаковых условиях. Газы можно считать идеальными. |
| Решение | Вспомним химические формулы газов в нашей задаче. Метан — Если правую и левую части уравнения (1.1) разделить на объем (V), то получим: Из формулы (1.2) выразим плотность газа: По условию задачи параметры Для нахождения молярных масс газов воспользуемся таблицей Менделеева. Получим |
| Ответ |
| Задание | На рисунке 5 представлен процесс в идеальном газе, который проводят при переменной массе, но постоянном давлении. Как изменяется масса газа в этом процессе?
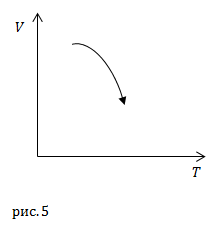
|
| Решение | Для решения задачи будем использовать уравнение Менделеева-Клапейрона:
Выразим из него массу газа, получим: По условию задачи давление в процессе остается постоянным. Следовательно, за поведение массы будет отвечать отношение |
| Ответ |











