График адиабатического процесса
Определение адиабатического процесса
Этот процесс является идеализированным, однако процессам близкими к адиабатическим можно считать процессы, которые проводят с высокой скоростью.
Уравнение, описывающее течение адиабатического процесса в идеальном газе получают, например, из первого начала термодинамики. В параметрах ![]() (давление, объем) оно имеет вид:
(давление, объем) оно имеет вид:
![]()
где ![]() – показатель адиабаты;
– показатель адиабаты; ![]() – число степеней свободы молекулы идеального газа.
– число степеней свободы молекулы идеального газа.
В параметры p (T) или V(T) выражения (2) легко перевести, применяя уравнение состояния идеального газа, тогда уравнение адиабатического процесса записывается как:
![]()
или
![]()
![]()
или
![Rendered by QuickLaTeX.com \[\frac{T_2}{T_1}={\left(\frac{p_2}{p_1}\right)}^{\frac{\gamma -1}{\gamma }} \qquad (3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1fd44da92bf79f69933216e46b7c7e0b_l3.png)
График адиабатического процесса
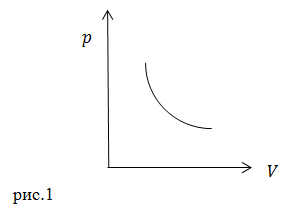
Линии, которые изображают на термодинамической диаграмме адиабатический процесс, называют адиабатами. Зная уравнение адиабатического процесса можно изобразить его диаграмму (начертить график процесса, изобразить адиабату) (рис.1) для параметров ![]() .
.
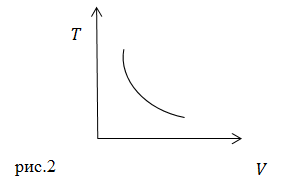
Используя уравнения (2) получим графическое изображение адиабатического процесса в виде рис.2.
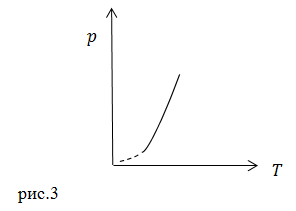
Для уравнения (3) адиабата представлен на рис.3.
Адиабатный процесс еще называют изоэнтропийным процессом, так как в этом процессе энтропия идеального газа не изменяется:
![]()
Тогда на диаграмме ![]() адиабату изображают как на рис.4
адиабату изображают как на рис.4
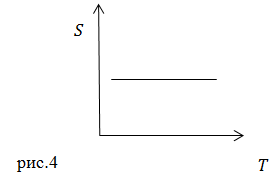
Примеры решения задач
| Задание | На рис. 5 изображены адиабата и изотерма для одного и того же идеального газа. Объясните, почему адиабата идет более круто, чем изотерма?
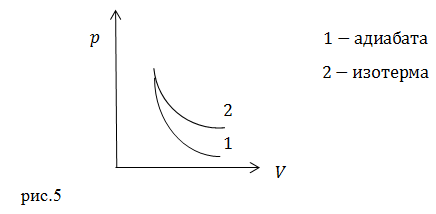
|
| Решение | Запишем уравнение изотермического процесса как:
Уравнение адиабаты в таких же параметрах имеет вид: где коэффициент Пуассона |
| Задание | Идеальный газ совершает цикл, который изображен на рис. 6. В изобарном процессе (1-2) газ нагревают от 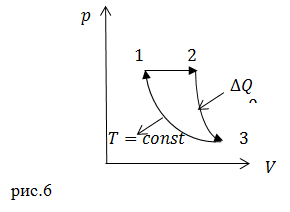
|
| Решение | Исходя из рис.6 мы получаем, что цикл состоит из процессов:
1-2 изобарное расширение, в котором газу подводят тепло ( 1-3 адиабатическое расширение; 3-1 изотермическое сжатие, отвод тепла ( Формулу для вычисления КПД цикла запишем как: Количество теплоты, получаемое газом в изобарном процессе, найдем из первого начала термодинамики: Количество теплоты, которое рабочее тело отдает холодильнику в процессе изотермического сжатия, найдем, также из первого начала термодинамики: где учтено, что в изотермическом процессе внутренняя энергия газа не изменяется. Найдем работу, которую совершают над газом в процессе 3-1, опираясь на определение работы в термодинамике: Используя уравнение состояния газа, выразим давление: Тогда работа в изотермическом процессе равна: Для преобразования выражения (2.6) использовано уравнение адиабатического процесса и закон Гей-Люссака. Получаем, что: Тогда КПД цикла равно: |
| Ответ |






![Rendered by QuickLaTeX.com \[A=\int^{V_3}_{V_1}{pdV} \qquad (2.4)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-de459dfe4b55e9547f894ac92267bf4f_l3.png)
![Rendered by QuickLaTeX.com \[\eta =\frac{\nu \frac{i+2}{2}R\left(T_2-T_1\right)-\nu RT_1\frac{i+2}{2}{\ln \left(\frac{T_2}{T_1}\right)}}{\nu \frac{i+2}{2}R\left(T_2-T_1\right)}=\frac{\left(T_2-T_1\right)-T_1{\ln \left(\frac{T_2}{T_1}\right)}}{\left(T_2-T_1\right)}\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-649667b803061b4a0b3ab45e26fbc96f_l3.png)





