Формулы адиабатического процесса
Это идеализированный процесс. Близкими к адиабатическим процессам являются процессы, происходящие с большой скоростью.
Формулу, которая описывает адиабатический процесс в идеальном газе легко получить из первого начала термодинамики, которое для этого процесса принимает вид:
![]()
уравнение (1) означает то, что работа в адиабатическом процессе совершается за счет уменьшения внутренней энергии системы. По определению работы в термодинамическом процессе, имеем:
![]()
где p – давление газа; ![]() – малое изменение объема системы. По определению внутренняя энергия:
– малое изменение объема системы. По определению внутренняя энергия:
![]()
где i – число степеней свободы молекулы; ![]() – количество вещества; R – универсальная газовая постоянная;
– количество вещества; R – универсальная газовая постоянная; ![]() – элементарное изменение температуры.
– элементарное изменение температуры.
Учитывая выражения (2) и (3) первое начало термодинамики для адиабатного процесса, запишем как:
![]()
Состояние идеального газа можно описать уравнением Менделеева – Клапейрона:
![]()
Из (5), получаем:
![]()
Подставим вместо ![]() в формулу (6) правую часть выражения (4):
в формулу (6) правую часть выражения (4):
![]()
где для идеального газа ![]() – показатель адиабаты (или коэффициент Пуассона). Из полученного дифференциального уравнения имеем:
– показатель адиабаты (или коэффициент Пуассона). Из полученного дифференциального уравнения имеем:
![]()
Уравнение (7) можно считать формулой, которая описывает адиабатический процесс (уравнение адиабаты, уравнение Пуассона). Формулы для адиабатического процесса можно легко получить в других параметрах: (p(T) или V(T)).
![Rendered by QuickLaTeX.com \[\frac{p_2}{p_1}={\left(\frac{V_1}{V_2}\right)}^{\gamma };\ \frac{T_2}{T_1}={\left(\frac{V_1}{V_2}\right)}^{\gamma -1};\ \frac{T_2}{T_1}={\left(\frac{p_2}{p_1}\right)}^{\frac{\gamma -1}{\gamma }} \qquad(9)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-29af0993bbd0711101c08c1edb920435_l3.png)
Диаграмма адиабатического процесса в осях p(V) является гиперболой.
Адиабатический процесс происходит при постоянной теплоемкости, равной нулю.
Примеры решения задач по теме «Адиабатический процесс»
| Задание | Газ расширяется и переходит из одного и того же состояния с объемом |
| Решение | Формула, описывающая изотермический процесс в параметрах Адиабатический процесс задает формула: где 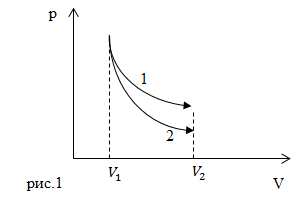
На рис. 1 изображен изотермический процесс расширения идеального газа от объема Если рассматривать процесс изменения объема газа в осях |
| Ответ | Работа в изотермическом процессе больше. |
| Задание | В сосуде под поршнем находится идеальный газ при температуре |
| Решение | Адиабатический процесс опишем при помощи формулы в параметрах (T V):
где показатель адиабаты найдем, как: учитывая, что водород двухатомный газ, следовательно, Учитывая (2.3) имеем: Проведем вычисления искомой температуры: |
| Ответ | |






![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (1.1)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0d94989f5d448e62b6b918c13e3a540c_l3.png)





