Метан
Характеристики и физические свойства метана
Температура его кипения равна -161,5oС, температура затвердевания -182,5oС. Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
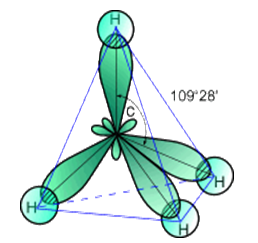
Рис. 1. Строение молекулы метана.
Получение метана
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Синтетические способы получения метана показывают взаимосвязь неорганических веществ с органическими. Можно выделить промышленные (1, 2, 3) и лабораторные (4, 5) способы его получения:
C + 2H2→CH4 (kat = Ni, t0) (1);
CO + 3H2→ CH4 + H2O (kat = Ni, t = 200 – 300oC) (2);
CO2 + 4H2→ CH4↑ + 2H2O (kat, t0) (3);
Al4C3 + 12H2O → CH4↑ + 4Al(OH)3 (4);
CH3COONa + NaOH→ CH4↑ + Na2CO3 (5).
Химические свойства метана
Метанпредставляет собой малореакционноспособное органическое соединение. Так, в обычных условиях он не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Все химические превращения, характерныедля метана протекают с расщеплением cвязейC-H:
- галогенирование (SR)
CH4 + Cl2→ CH3Cl + HCl (hν);
- нитрование (SR)
CH4 + HONO2 (dilute)→ CH3-NO2 + H2O (t0);
- сульфохлорирование (SR)
CH4 + SO2 + Cl2→ CH3-SO2Cl + HCl↑ (hν);
Различают каталитическое (в качестве катализаторов применяют соли меди и марганца) (1, 2, 3) и полное (сгорание) (4) окисление метана:
2CH4 + O2→ 2CH3OH (p, t0) (1);
CH4 + O2→ HC(O)H + H2O (NO, t0) (2);
2CH4 + 3O2→ 2HCOOH + 2H2O (kat = Pt, t0) (3);
CH4 + 2O2→CO2 + 2H2O + Q (4).
Конверсию метана водяным паром и диоксидом углерода также можно отнести к способам его окисления:
CH4 + H2O →CO + 3H2 (kat = Ni, t = 800oC);
CH4 + CO2→ 2CO + 2H2.
Крекинг метана – важнейший метод химической переработки нефти и её фракций с целью получения продуктов меньшей молекулярной массы – смазочных масел, моторных топлив и т.д., а также сырья для химической и нефтехимической промышленности:
2CH4→ HC≡CH + 3H2 (t = 1500oC).
Применение метана
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений – спиртов, альдегидов, кислот.
Примеры решения задач
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 11,2 л метана. |
| Решение | Запишем уравнение реакции хлорирования метана:
CH4 + Cl2 = CH3Cl + HCl. Найдем количество вещества метана: n = V/ Vm; n(CH4) = V(CH4) / Vm; n(CH4) = 11,2/22,4 = 0,5 моль. Согласно уравнению реакции n(CH4) :n(Cl2) = 1:1, значит,количество моль хлора равно: n(Cl2) = n(CH4) =0,5 моль. Тогда, масса хлора будет равна (молярная масса – 71 г/моль): m(Cl2) = n(Cl2) × M(Cl2); m(Cl2) = n(Cl2) × M(Cl2); m(Cl2)=0,5×71=35,5 г. |
| Ответ | Масса хлора равна 35,5 г. |
| Задание | Рассчитайте объемы хлора и метана, приведенные к нормальным условиям, которые потребуются для получения тетрахлорида углерода массой 38,5 г. |
| Решение | Запишем уравнение реакции хлорирования метана до тетрахлорида углерода (реакция происходит под действием УФ-излучения):
CH4 + 4Cl2 = CCl4 + 4HCl. Рассчитаем количество вещества тетрахлорида углерода (молярная масса равна – 154 г/моль): n = m / M; n(CCl4) = m (CCl4) / M (CCl4); n(CCl4) = 38,5 / 154 = 0,25 моль. Согласно уравнению реакции n(CCl4) : n(CH4) = 1:1, т.е. n(CCl4) = n(CH4) = 0,25 моль. Тогда объем метана будет равен: V = n × Vm; V(CH4) = n(CH4) × Vm; V(CH4) = 0,25 × 22,4 = 5,6 л. По уравнению реакции найдем количество вещества хлора. n(CCl4) : n(Cl2) = 1:4, т.е. n(Cl2) =4 × n(CCl4) = 4 × 0,25 = 1 моль. Тогда объем хлора будет равен: V = n × Vm; V(Cl2) = n(Cl2) × Vm; V(Cl2) = 1 × 22,4 = 22,4 л. |
| Ответ | Объемы хлора и метана равны 22,4 и 5,6 л соответственно. |











