Плотность метана
Плотность метана и другие его физические свойства
Метан – главная составная часть нефтяного и природного газов. Он применяется как высококалорийное топливо в составе природного газа.
Основные константы метана приведены в таблице ниже.
Таблица 1. Физические свойства и плотность метана.
|
Плотность, кг/м3 |
0,7168 (0oС) 0,6682 (25oС) |
|
Температура плавления, oС |
-182,49 |
|
Температура кипения, oС |
-161,58 |
|
Молярная масса, г/моль |
16,04 |
Химический состав и строение молекулы метана
Химический состав молекулы метана выражается эмпирической формулой CH4. Рассмотрим более подробно её строение, для чего необходимо ввести понятие «гибридизации атомных орбиталей в молекуле».
Гибридизацией называется изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей.
В молекуле метана (рис. 1) гибридизации подвергаются одна s-орбиталь и три p-орбитали атома углерода. Вид и число орбиталей, участвующих в гибридизации определяет её тип. В пространстве эти орбитали расположены относительно друг друга под одинаковыми углами и направлены к вершинам тетраэдра.Тип гибридизации атомов углерода в молекуле метана – sp3.
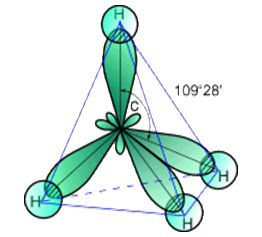
Рис. 1. Строение молекулы метана.
При образовании молекулы метана sp3— гибридизованные орбитали атома углерода перекрываются с p-орбиталями атомов водорода. Гибридные орбитали атома углерода направлены к вершинам воображаемого тетраэдра, что и объясняет тетраэдрическую форму молекулы метана.
Краткое описание химических свойств и плотность метана
Метан – первый представитель гомологического ряда предельных углеводородов – алканов. Он способен вступать в реакции радикального замещения (галогенирование, нитрование [Коновалова], сульфохлорирование [Рида], сульфоокисление и т.д.), однако ему не свойственна высокая реакционная способность.
Реакция галогенирования метана протекает по цепному механизму и обязательно на свету:
CH4 + Cl2 = CH3Cl + HCl;
CH3Cl + Cl2 = CH2Cl2 + HCl;
CH2Cl2 + Cl2 = CHCl3 + HCl;
CHCl3 + Cl2 = CCl4 + HCl.
Метан, как и другие органические соединения сгорает на воздухе сине-голубоватым пламенем, выделяя при этом значительное количество теплоты:
CH4 + O2 = CO2 + H2O.
Метан используется как сырье для получения целого ряда органических веществ, например метанола, уксусной кислоты, ацетальдегида:
CO + 2H2 = CH3OH.
Примеры решения задач
| Задание | Вычислите плотность по водороду смеси 25 л фтора и 175 л хлора. |
| Решение | Найдем объемные доли веществ в смеси:
φ = Vgas / Vmixture_gas; φ (F2) = V(F2) / Vmixture_gas; φ (F2) = 25 / (25 + 175) = 25 / 200 = 0,125. φ (Cl2) = V(Cl2) / Vmixture_gas; φ (Cl2) = 175 / (25 + 175) = 175 / 200 = 0,875. Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси: Mrconditional (mixture) = φ (F2) ×Mr(F2) + φ (Cl2) ×Mr(Cl2); Mrconditional (mixture) = 0,125 × 38 + 0,875 ×71 = 4,75 + 62,125 = 66,875. Найдем относительную плотность смеси по водороду: DH2(mixture) = Mrconditional (mixture) / Mr(H2); DH2(mixture) = 66,875 / 2 = 33,44. |
| Ответ | Плотность по водороду смеси, состоящей из фтора и хлора равна 33,44. |
| Задание | Рассчитайте плотности газов хлороводорода HCl и пропана C3H8 по воздуху. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Dair(HCl) = Mr(HCl) / Mr(air); Dair(HCl) = 36,5 / 29 = 1,26. Mr(HCl) = Ar(Cl) + Ar(H) = 35,5 + 1 = 36,5. Dair(C3H8) = Mr(C3H8) / Mr(air); Dair(C3H8) = 44 / 29 = 1,52. Mr(C3H8) = 3×Ar(С) + 8×Ar(H) = 3×12 + 8× 1 = 36 + 8 = 44. |
| Ответ | Плотности хлороводорода HCl и пропана C3H8 по воздуху равны 1,26 и 1,52 соответственно. |











