Формула серебра
Определение и формула серебра
Серебро характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 10,5 г/см3. Температура плавления 961,2oC, кипения 2170oC.

Рис. 1. Серебро. Внешний вид.
Химическая формула серебра
Химическое обозначение серебра – Ag от латинского слова «argentum». Этот химический элемент расположен в пятом периоде в IВ группе Периодической таблицы Д.И. Менделеева. Относится к элементамd-семейства. Металл. Относительная атомная масса серебра равна 107,8682 а.е.м.
Электронная формула серебра
В ядре атома серебра содержится 47 протонов и 61 нейтрон (массовое число равно 108). В атоме серебра есть пять энергетических уровней, на которых находятся 47 электронов (рис. 2).
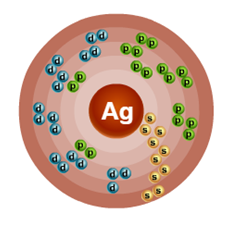
Рис. 2. Строение атома серебра.
Электронная формула атома серебра в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64d95s2.
Примеры решения задач
| Задание | При сжигании 24,6 г вещества образовалось 26,88 л углекислого газа (при н.у.), 9 г воды и 2,24 л азота (при н.у.). 1 литр паров этого вещества (при н.у.) имеет массу 5,491 г. На основании данных условия задания проведите необходимые вычисления и установите молекулярную формулу исходного органического вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyNzOw + Oz →CO2 + H2O + N2. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м., Ar(N) = 14 а.е.м. Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = n(C)×M(C) = n(CO2)×M(C) = [V(CO2) / Vm]×M(C); m(C) = [26,88 / 22,4]×12 = 14,4 г. m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); m(H) = [2×9 / 18]×1 = 1 г. m(N) = n(N)×M(N) = 2×[V(N2) / Vm]; m(N) = 2×[2,24 / 22,4] = 1,28 г. m(O) = m(CxHyNzOw) – m(C) – m(H) – m(N) = 24,6 – 14,4 – 1 – 1,28 = 6,4 г Определим химическую формулу соединения: x:y:z:w = m(C)/Ar(C) : m(H)/Ar(H) : m(N)/Ar(N) : m(O)/Ar(O) x:y:z:w= 14,4/12 : 1/1 : 1,28/14 : 6,4/16; x:y:z:w= 1,2 : 1 : 0,09 : 0,4 = 13 : 11 : 1 : 4. Значит простейшая формула соединения C13H11NO4и молярную массу 30 г/моль [M(C13H11NO4) = 13×Ar(C) + 11×Ar(H) +Ar(N) + 3× Ar(O) = 13×12 + 11×1 + 14 + 3×16 =156 + 11 + 14 + 48 = 229 г/моль]. Найдем истинную молярную массу органического вещества: M(CxHyNzOw) = m(CxHyNzOw) × Vm/ V(CxHyNzOw); M(CxHyNzOw) = 5491 × 22,4 / 1 = 123 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение истинной и полученной молярных масс: M(CxHyNzOw) / M(C13H11NO4) = 123 / 229 = 0,5. Значит индексы атомов углерода, водорода и кислорода должны быть умножены на 0,5, т.е. формула вещества будет иметь вид C6H5NO2. Это нитробензол. |
| Ответ | C6H5NO2 |
| Задание | Одноосновная карбоновая кислота содержит 26,1% углерода и 4,3% водорода. На основании данных условия задания произведите необходимые вычисления и установите молекулярную формулу органического вещества. |
| Решение | Запишем молекулярную формулу одноосновной карбоновой кислоты в общем виде как CxHyOw.
Известно, что ω(С) — ω(H) — ω(O) = 100%. Тогда, массовая доля кислорода в составе предельной одноосновной карбоновой кислоты будет рассчитываться как: ω(O) =100% — ω(С) — ω(H); ω(O) =100% — 26,1 – 4,3 = 69,6%. Процентное содержание элементов разделим на соответствующие относительные атомные массы (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y:w = ω(С)/Ar(С) : ω (H)/Ar(H) : ω(O)/Ar(O); x:y:w= 26,1/12 : 4,3/1 : 69,6/16; x:y:w: = 2,18 : 4,3 : 4,35 = 1: 2 : 2. Значит простейшая формула одноосновной карбоновой кислоты будет иметь вид CH2O2 или HCOOH. Это муравьиная кислота. |
| Ответ | HCOOH |











