Формула сульфида железа 2
Определение и формула сульфида железа 2
Не разлагается в воде, однако, разлагается кислотами.

Рис. 1. Сульфид железа (II). Внешний вид.
Химическая формула сульфида железа 2
Химическая формула сульфида железа (II) FeS. Она показывает, что в состав данной молекулы входят один атом железа (Ar = 56 а.е.м.) и один атом серы (Ar = 32 а.е.м.). По химической формуле можно вычислить молекулярную массу сульфида железа (II):
Mr(FeS) = Ar(Fe) + Ar(S);
Mr(FeS) = 56 +32 = 88.
Графическая (структурная) формула сульфида железа 2
Структурная (графическая) формула сульфида железа (II) является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
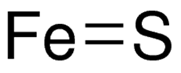
Ионная формула
Сульфид железа (II) является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
FeS ↔ Fe2+ + S2-.
Примеры решения задач
| Задание | При полном сгорании 6 г органического вещества образовалось 8,8 г оксида углерода (IV) и 3,6 г воды. Определите молекулярную формулу сожженного вещества, если известно, что его молярная масса равна 180 г/моль. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [8,8 / 44]×12 = 2,4 г; m(H) = 2×3,6 / 18 ×1= 0,4 г. m(O) = m(CxHyOz) – m(C) – m(H) = 6 – 2,4 – 0,4 = 3,2 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 2,4/12 :0,4/1 :3,2/16; x:y:z= 0,2 : 0,4 : 0,2 = 1: 2 : 1. Значит простейшая формула соединения CH2Oи молярную массу 30 г/моль [M(CH2O) = Ar(C) + 2×Ar(H) + Ar(O) = 12 + 2×1 + 16 = 12 + 2 + 16 = 30 / моль]. Чтобы найти истинную формулу органического соединения найдем отношение истинной и полученной молярных масс: Msubstance / M(CH2O) = 180 / 30 = 6. Значит индексы атомов углерода, водорода и кислорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H12O6. Это глюкоза или фруктоза. |
| Ответ | C6H12O6 |
| Задание | При сжигании 6,5 г газообразного органического соединения получено 11,2 л (н.у.) углекислого газа и 4,5 г воды. Относительная плотность этого соединения по водороду равна 13. Выведите его химическую формулу. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)]×M(H). Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×4,5 / 18] ×1 = 0,5 г. m(O) = m(CxHyOz) – m(C) – m(H) = 6,5 – 6 – 0,5 = 0, что свидетельствует о том, что в составе данного органического вещества нет. Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y =6/12 :0,5/1; x:y = 0,5 : 0,5 = 1: 1. Значит простейшая формула соединения CHи молярную массу 13 г/моль [M(CH) = Ar(C) + Ar(H)= 12 + 1 = 13 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 13 = 26 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH) = 26 / 13 = 2. Значит индексы атомов углерода и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид C2H2. Это ацетилен. |
| Ответ | C2H2 |











