Формула нитрата калия
Определение и формула нитрата калия

Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – это твёрдое кристаллическое вещество, представляющее из себя бесцветные ромбические или гексагональной кристаллы, с плотностью 2,11 г/см![]() , хорошо растворяется в воде 31,6 г/100 г (
, хорошо растворяется в воде 31,6 г/100 г (![]() ), температура плавления
), температура плавления ![]() , при
, при ![]() разлагается.
разлагается.
Химические свойства нитрата калия
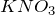 взаимодействует с восстановителями:
взаимодействует с восстановителями:
![Rendered by QuickLaTeX.com \[ KNO_3 + 2H (Zn + HCl) = KNO_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6d6a993f1e4f416695b27d7c8e9aa936_l3.png)
![Rendered by QuickLaTeX.com \[ 2KNO_3 + (NH_4)_2SO_4 = K_2SO_4 + 2N_2O \uparrow + 4H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-31fe1f97d95debb87ee2081297e67de2_l3.png)
![Rendered by QuickLaTeX.com \[ 6KNO_3 + 10Al = 6KAlO_2 + 2Al_2O_3 + 3N_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cbe083204e026baf382f60aaf4905cf5_l3.png)
![Rendered by QuickLaTeX.com \[ KNO_3 + Pb = KNO_2 + PbO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d40f1150802b2fae8bc93d088b6b44b4_l3.png)
![Rendered by QuickLaTeX.com \[ 3KNO_3 + 2KOH + Fe = K_2FeO_4 + 3KNO_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2dac6896ab098137390a95239064632a_l3.png)
- При нагревании
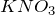 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ 2KNO_3 = 2KNO_2 + O_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bd2edecee5892725862c06474262867e_l3.png)
Получение
Нитрат калия получают с помощью следующих реакций:
![]()
![]()
Качественная реакция
Качественной реакцией на ионы калия является образование жёлтого кристаллического осадка гексанитрокобальтата (III) калия-натрия при добавлении к раствору гексанитрокобальтата (III) натрия:
![]()
Применение
Нитрат калия в основном применяют в качестве удобрения, используют также в пиротехнике, в создании дымного пороха, производстве прочного стекла, в переработке никелевой руды, в пищевой промышленности как консервант.
Примеры решения задач
| Задание | Рассчитайте изменение энергии Гиббса и константу равновесия реакции термического разложения |
| Решение | Запишем уравнение реакции:
Найдем стандартное изменение энергии Гиббса: Рассчитаем константу равновесия: Рассчитаем первоначальное парциальное давление кислорода Рассчитаем изменение энергии Гиббса: |
| Ответ |
| Задание | Рассчитайте производную ЭДС по температуре при |
| Решение | Запишем реакцию и уравняем ее:
Рассчитаем изменение энтропии реакции: Рассчитаем производную ЭДС по температуре при постоянном давлении: |
| Ответ |











