Идеальный газ
Это газ, который состоит из материальных точек, имеющих конечную массу, но не имеющих объема. Данные частицы не могут взаимодействовать на расстоянии. Столкновения частиц идеального газа описываются при помощи законов абсолютно упругого соударения шаров. Следует отметить, что имеются в виду законы столкновения именно шаров, так как точечные частицы испытывают только лобовые столкновения, которые не могут изменять направления скоростей на разные углы.
Идеальный газ существует только в теории. В реальной жизни он не может существовать в принципе, так как точечные молекулы и отсутствие их взаимодействия на расстоянии аналогично их существованию вне пространства, то есть их не существованию. Ближе всех по своим свойствам к модели идеального газа приближаются газы при малом давлении (разреженные газы) и (или) высокой температуре. Модель идеального газа подходит для изучения методов исследования систем многих частиц, знакомства с соответствующими понятиями.
В промежутках между столкновениями молекулы идеального газа движется по прямым. Законы столкновений и соударений о стенки сосудов, в которых находится газ, известны. Следовательно, если знать положения и скорости всех частиц идеального газа в какой-то момент времени, то можно найти их координаты и скорости в любой другой момент времени. Эта информация наиболее полно описывает состояние системы частиц. Однако количество частиц столь велико, что динамическое описание системы многих частиц непригодно для теории и бесполезно для практики. Это означает, что для изучения систем многих частиц информация должна быть обобщена, и ее относят не к отдельным частицам, а к их большим совокупностям.
Давление идеального газа
При помощи модели идеального газа удалось качественно и количественно объяснить давление газа на стенки сосуда, в котором он находится. Газ оказывает давление на стенки сосуда потому, что его молекулы взаимодействуют со стенками как упругие тела по законам классической механики. Количественно давление (p) идеального газа получили равным:
![]()
где ![]() — средняя кинетическая энергия поступательного движения молекул газа;
— средняя кинетическая энергия поступательного движения молекул газа; ![]() — концентрация молекул газа (N – число молекул газа в сосуде; V – объем сосуда).
— концентрация молекул газа (N – число молекул газа в сосуде; V – объем сосуда).
Законы идеальных газов
Идеальным называют газы, которые строго подчиняются законам Бойля – Мариотта и Гей – Люссака.
Закон Бойля – Мариотта. Для постоянной массы (m) идеального газа при постоянной температуре (T) произведение давления (p) газа на его объем (V) является постоянной величиной для любых состояний рассматриваемого вещества:
![]()
Закон Гей-Люссака. Для постоянной массы газа при неизменном давлении выполняется соотношение:
![]()
В поведении реальных газов наблюдают отступления от законов Бойля — Мариотта и Гей-Люссака, и эти отступления различны для разных газов.
Для идеального газа выполняется закон Шарля. Который говорит о том, что для постоянной массы газа, при постоянном объеме, отношение давления газа к температуре, не изменяется:
![]()
Для связи параметров идеального газа, часто используют уравнение состояния, которое носит имена двух ученых Клапейрона и Менделеева:
![]()
где ![]() — молярная масса газа;
— молярная масса газа; ![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Закон Дальтона. Давление смеси идеальных газов (p) равно сумме парциальных давлений (![]() ) рассматриваемых газов:
) рассматриваемых газов:
![Rendered by QuickLaTeX.com \[p=\sum^m_{i=1}{p_i} \qquad (3) \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6c2e826653d772abcd4695d3c5eba0db_l3.png)
При этом уравнение состояния смеси идеальных газов имеет вид (2), как будто газ является химически однородным.
Примеры решения задач
| Задание | Какие процессы в неизменной массе идеального газа представляют графики (рис.1)?
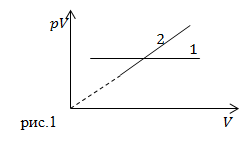
|
| Решение | Рассмотрим процесс изображенный графиком под номером 1. Мы видим, что произведение Перейдем ко второму графику. Из графика мы можем сделать вывод о том, что: где С – некоторая постоянна величина. Разделим правую и левую части выражения (1.1) имеем: Мы получили, что давление постоянно. Так как |
| Ответ | 1- изотермический процесс. 2- изобарный процесс. |
| Задание | Как будет изменяться давление идеального газа в процессе при котором масса газа постоянна, объем газа увеличивают, а температуру уменьшают? |
| Решение | За основу решения задачи примем уравнение Клапейрона – Менделеева:
Зная, что масса газа не изменяется, обозначим величину В этом уравнении обозначим направление изменение параметра стрелками ( В формуле (2.3) мы видим, что числитель дроби уменьшается, знаменатель растет, следовательно, результат (давление) в процессе уменьшается. |
| Ответ | Давление уменьшается. |











