Свойства идеального газа
При невысоких давлениях и температурах (температура не должна быть и очень низкой) газообразные вещества являются наиболее простыми по своим свойствам. При выше названных условиях у таких газов как кислород, азот и водород и других, индивидуальные свойства сглаживаются, и нет существенных отличий по сжимаемости и тепловому расширению. Поэтому вводят модель идеального газа как предельного состояния реальных газов при низких давлениях. Гелий и водород при атмосферном давлении являются наиболее близкими к состоянию идеального газа.
Схожесть свойств идеальных газов можно объяснить тем, что при невысоких давлениях индивидуальные черты молекул разных веществ, которые связаны с их размерами и силами взаимодействия не оказывают влияние на некоторые свойства газа.
Изопроцессы в идеальных газах
Изотермический процесс рассматривали Р. Бойль и Э. Мариотт в семнадцатом веке. Этот процесс проводят с идеальным газом постоянной массы при неизменной температуре. При этом давление газа (p) изменяется обратно пропорционально его объему (V):
![]()
Зависимость (1) на графике отображают при помощи линий, которые называют изотермами. В осях ![]() изотерма представляет собой гиперболу. Выражение (1) ведет к линейной зависимости между давлением и плотностью идеального газа в изотермическом процессе:
изотерма представляет собой гиперболу. Выражение (1) ведет к линейной зависимости между давлением и плотностью идеального газа в изотермическом процессе:
![]()
Изотермический коэффициент сжатия (![]() ) идеального газа обратно пропорционален давлению:
) идеального газа обратно пропорционален давлению:
![]()
Изобарический процесс исследовал Л. Гей-Люссак в девятнадцатом веке. Его закон говорит о том, что объем (V) постоянной массы идеального газа и неизменном давлении изменяется прямо пропорционально температуре:
![]()
Графически закон Гей-Люссака изображают при помощи изобар.
Процесс, проводимый с постоянной массой газа и постоянным объемом, называют изохорным. Закон его описывающий называют законом Шарля:
![]()
Графически изохорный процесс изображают изохорами.
Закон Авогадро
В начале 19 века А. Авогадро предположил, что одинаковые объемы разных газов при одной температуре и давлении, содержат одинаковое число молекул. Закон Авогадро можно получить из молекулярно кинетической теории. Один моль любого газа при одинаковых условиях занимают одинаковые объемы. Для ![]() моль:
моль:
![]()
где ![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Уравнение состояние идеального газа
Уравнение, вошедшее в физику во второй половине девятнадцатого век благодаря Б. Клапейрону и Д.И. Менделееву:
![]()
где ![]() – молярная масса газа.
– молярная масса газа.
Идеальный газ можно определить так: идеальным можно назвать газ, состояние которого можно описать при помощи уравнения Менделеева – Клапейрона.
Примеры решения задач
| Задание | Изобарный процесс в осях 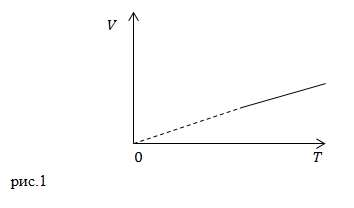
|
| Решение | На рис.1 по горизонтальной оси откладывают температуру по шкале Кельвина (термодинамической температурной шкале), при этом T – абсолютная температура, которая связана с температурой по школе Цельсия (t) как
В таком случае в осях 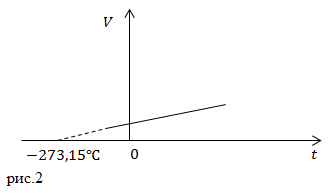
Следует заметить, что: Одинаковыми будут производные, если брать их с использованием разных температурных кал: При переходе от шкалы Кельвина к шкале Цельсия сохраняются определения термических коэффициентов объемного расширения и коэффициента давления. |
| Задание | Какова плотность смеси идеальных газов, параметры которых: первого |
| Решение | Плотность смеси газов ( где где Уравнение состояния идеального газа в смеси: Выразим из уравнения (2.3) объем и подставим его в (2.1), имеем: |
| Ответ |






![Rendered by QuickLaTeX.com \[\rho =\frac{\left(m_1+m_2\right)p}{\left(\frac{m_1}{{\mu}_1}+\frac{m_2}{{\mu}_2}\right)RT}\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-03fb0e99bd71543a334aa9f406e62383_l3.png)





