Валентность олова
Общие сведения о валентности олова
В свободном состоянии олово- серебристо-белый мягкий металл. При нагревании палочки олова слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга. Олово обладает мягкостью и тягучестью и легко может быть прокатано в тонкие листы (станиоль).
Кроме обычного белого олова (тетрагональная кристаллическая решетка) существует серое олово (кубическая кристаллическая решетка), характеризующееся меньшим значением плотности. Белое олово устойчиво при температурах выше 14oС, а серое – при температурах ниже 14oС.
Валентность олова в соединениях
Олово – пятидесятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в пятом периоде в IVA группе. В ядре атома олова содержится 50 протонов и 69 нейтронов (массовое число равно 119). В атоме олова есть пять энергетических уровней, на которых находятся 50 электронов (рис. 1).
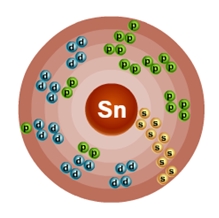
Рис. 1. Строение атома олова.
Электронная формула атома олова в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64d105s25p2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
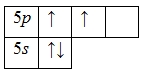
Наличие двух неспаренных электронов свидетельствует о том, что олово проявляет валентность II в своих соединениях (SnO, Sn(OH)2, SnCl2, SnS, SnBr2).
Для олова характерно наличие возбужденного состояния: электроны 5s-уровня распариваются и один из совершает переход на вакантную орбиталь 5p-подуровня:
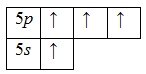
Наличие четырех неспаренных электронов свидетельствует о том, что олово также проявляет валентность IV в своих соединениях (SnH4, SnO2, SnBr4, Sn(SO4)2, SnI4).
Примеры решения задач
| Задание | Напишите уравнения реакций в молекулярной форме, которые отражают амфотерный характер оксида олова (IV). |
| Ответ | Оксид олова (IV) проявляет амфотерные свойства, т.е способен взаимодействовать как с кислотами, так и с основаниями:
SnO2 + 2H2SO4 (dilute, hot) = Sn(SO4)2 + H2O; SnO2 + 2NaOH (conc) + 2H2O = Na2[Sn(OH)6]; SnO2 + 2NaOH = Na2SnO3 + H2O. |
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Sn → SnCl2 → Sn(OH)2 → K2Sn(OH)6. |
| Ответ | При растворении олова в горячей соляной кислоте образуется хлорид олова (II):
Sn + HCl (hot)→SnCl2 + H2↑. При взаимодействии хлорида олова (II) с разбавленным раствором щелочи образуется осадок гидроксида олова (II): SnCl2 + 2NaOH (dilute) → Sn(OH)2↓ + 2NaCl. Гидроксид олова (II) проявляет амфотерные свойства, т.е. способен реагировать со щелочами с образованием комплексных соединений: Sn(OH)2 + 2KOH (conc) → K[Sn(OH)3]solution; 2K[Sn(OH)3]solution→ K2Sn(OH)6 + Sn↓. |











