Валентность химических элементов
Понятие «валентность»
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1

11Na 1s22s22p63s1
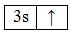
Валентность элементов главной подгруппы II группы
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be1s22s2

12Mg 1s22s22p63s2

При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
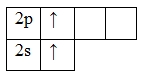
Mg*
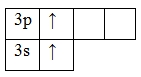
Валентность кислорода и фтор в химических соединениях
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум (II) для кислорода и единице (I) для фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет более свободных ячеек:
8O 1s22s22p4
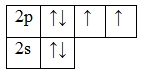
9F 1s22s22p5
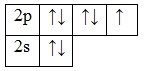
В то же время сера – аналог кислорода – проявляет переменную валентность II, IV, VI; хлор – аналог фтора – проявляет валентность I, III, V, VII. Это объясняется наличием свободных d-ячеек на третьем энергетическом уровне.
Для большинства d-элементов валентность в невозбужденном состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов и, чтобы определить валентность в этом случае, нужно знать, возможно ли для элемента возбужденное состояние.
Кроме этого значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Примеры решения задач
| Задание | Определите валентность элементов, входящих в состав сульфата алюминия по его формуле Al2(SO4)3. |
| Решение | Валентность кислорода постоянна и равна II. Поэтому начинаем решение задачи с этого элемента. Определяем Число атомов кислорода в молекуле сульфата алюминия. Оно равно 12. Вычисляем общее число единиц валентности кислорода:
12 × 2 = 24. Валентность алюминия можно определить при помощи Периодической таблицы Д.И. Менделеева. Она равна III, т.к. алюминий находится в IIIA группе. Число атомов алюминия равно 2-м. Вычисляем общее число единиц валентности алюминия: 2 × 3 = 6. Определяем число атомов серы в молекуле сульфата алюминия. Оно равно 3 — м. Находим разность между общим числом единиц валентности кислорода и алюминия: 24-6 = 18. Вычисляем валентность серы. Разделим полученную разность на число атомов серы в молекуле сульфата алюминия: 18/3 = 6. Валентность серы равна VI. |
| Ответ | Валентность серы равна VI. |
| Задание | Составьте формулу фосфата натрия. |
| Решение | Запишем формулу соли. Следует помнить, что в средних солях на первом месте всегда стоит атом металла, а за ним – кислотный остаток:
Nax(PO4)y. Расставляем валентности. Натрий – элемент IA группы, значит он одновалентен. Так как фосфорная кислота трехосновная, то валентность кислотного остатка равна III: NaxI(PO4)yIII. Находим общее кратное: 1×3 = 3. И определяем индексы для натрия и фосфат-иона. Они будут равны 3 и 1, соответственно. Т.е. формула фосфата натрия будет иметь вид: Na3PO4. |
| Ответ | Na3PO4. |











