Валентность ванадия
Общие сведения о валентности ванадия
Плотность – 6,11 г/см3. Температуры плавления и кипения равны 1920oС и 3400oС, соответственно. Физико-химические свойства ванадия сильно зависят от чистоты метала. Так, чистый металл отличается ковкостью, тогда как наличие примесей в нем сильно ухудшает его пластичность и повышают твердость. В обычных условиях – химически стойкий металл.
Валентность ванадия в соединениях
Ванадий находится в четвертом периоде в VB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 23. В ядре атома ванадия содержится 23 протона и 27 нейтронов (массовое число равно 50). В атоме ванадия есть четыре энергетических уровня, на которых находятся 23 электрона (рис. 1).
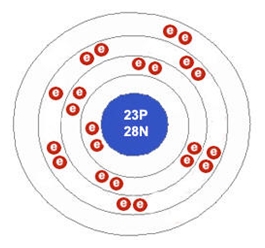
Рис. 1. Строения атома ванадия.
Электронная формула атома ванадия в основном состоянии имеет следующий вид:
1s22s22p63s23p63d34s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
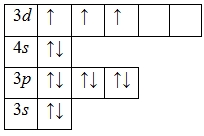
Наличие трех неспаренных электронов свидетельствует о том, что ванадий в своих соединениях может проявлять валентность III (VIII2O3, VIIIF3, VIIICl3).
Атом ванадия способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 3d-подуровня:
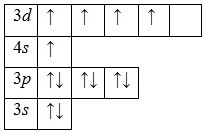
Наличие пяти неспаренных электронов свидетельствует о том, что ванадий также проявляет валентность V в своих соединениях (VV2O5, VVF5).
Известно, что у ванадия есть валентности II(VIIO) и IV (VIVO2, VIVCl4).
Примеры решения задач
| Задание | Подберите коэффициенты в схемах следующих окислительно-восстановительных реакций. Укажите, как изменяется степень окисления ванадия.
V + HNO3 = V2O5 + NO2 + H2O; V2O5 + HCl = VOCl2 + Cl2 + H2O. |
| Ответ | Подбирая коэффициенты для уравнения химических реакций, следует помнить о том, что количество атомов каждого из элементов правой части должно равняться количеству атомов элементов из левой части. Таким образом уравнения принимают следующий вид:
2V + 10HNO3 = V2O5 + 10NO2 + 5H2O; V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O. В первой реакции степень окисления ванадия изменяется с 0 до +5.Во втором – с +5 до +4. |
| Задание | Напишите формулы всех известных оксидов ванадия. Покажите, как изменяются кислотно-основные свойства этих оксидов с ростом степени окисления ванадия. |
| Ответ | Известны оксиды ванадия (II) (VO), III (V2O3), IV (VO2) и V (V2O5).
Для оксида ванадия (II) характерно проявление сильных основных свойств, в реакции он выступает в роли сильного восстановителя: 3VO = V2O3 + V. Оксид ванадия (III) проявляет основные свойства и также является восстановителем: Оксид ванадия (IV) проявляет амфотерные свойства в ОВР практически не участвует. Оксид ванадия (V) проявляет амфотерные свойства с преобладанием кислотных, в реакциях является сильным окислителем: V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O. |











