Степень окисления в аммиака
Общие сведения об аммиаке
Жидкий аммиак – это бесцветная жидкость, твердый – вещество белого цвета. Плотность – 0,7708л. Температура плавления – (-77,75oC), кипения – (-33,4oC). Брутто-формула – NH3 (строение молекулы показано на рис. 1). Молярная масса аммиака равна 17,03 г/моль.
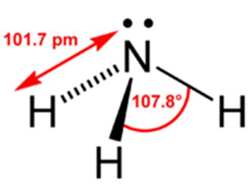
Рис. 1. Строение молекула аммиака с указанием валентного угла и длины химической связи.
Хорошо растворяется в воде, образует гидрат состава NH3×H2O, раствор которого имеет слабощелочную среду. Разбавленный раствор аммиака (3-10%) называют нашатырным спиртом, концентрированные растворы (18,5 – 25%) – аммиачной водой.
Весьма реакционноспособен, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами, металлами, галогенами, оксидами и галогенидами. Качественная реакция – почернение бумажки, смоченной раствором Hg2(NO3)2 (образование ртути).
Жидкий аммиак – основный протонный растворитель; хорошо растворяет серу, галогениды (кроме фторидов) и нитраты щелочных металлов, галогениды аммония и т.д.
Аммиак, степени окисления элементов в нем
Аммиак – это гидрид азота, а, как известно, водород в гидридах неметаллов всегда проявляет степень окисления равную (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3× (+1)= 0;
x +3 = 0;
x = -3.
Степень окисления азота в аммиаке равна (-3):
N-3H+13.
Примеры решения задач
| Задание | Максимальную степень окисления центральный элемент имеет в гидроксосоединении:
а) (HO)ClO2; б) (HO)3PO; в) (HO)2SO2; г) (HO)3P. |
| Решение | Для того, чтобы найти правильный ответ на поставленный вопрос будем поочередно проверять каждый из предложенных вариантов.
а) Центральным атомом является хлор. Примем значение степени окисления хлора за «х» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 1 + (-2) + х + 2×(-2) = 0; x -5 = 0; x = +5. б) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «у» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + у + (-2) = 0; y -5 = 0; y = +5. в) Центральным атомом является сера. Примем значение степени окисления серы за «z» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 2×1 + 2× (-2) + z + 2× (-2) = 0; z -6 = 0; z = +6. г) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «а» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + а = 0; a — 3 = 0; a = +3. Наименьшее значение степени окисления равно (+3), оно характерно для фосфора в соединении состава (HO)3P. |
| Ответ | Вариант (г) |
| Задание | Определите степени окисления серы в соединениях H2S, S, SO2 и SO3. Постройте шкалу степеней окисления серы. Для этого на числовую ось нанесите значения степеней окисления серы в соединениях, формулы которых расположите под цифровой осью. | ||||||||
| Ответ | а) Степень окисления водорода в соединениях с неметаллами равна (-1). Примем значение степени окисления серы за «x». Уравнение электронейтральности будет выглядеть следующим образом:
1×2 + х = 0; x = -2. Степень окисления серы равна (-2). б) Степень окисления элемента в простом веществе всегда равна 0. в) Степень окисления кислорода в оксидах равна (-2). Примем значение степени окисления серы за «x». Уравнение электронейтральности будет выглядеть следующим образом: x + 2 × (-2)= 0; x -4 = 0; x = +4. Степень окисления серы равна (+4). г) Аналогично варианту (в) определяем, что степень окисления серы в SO3 равна (+6). Шкала степеней окисления серы будет выглядеть следующим образом:
|











