Степень окисления в OF2
Общие сведения о фториде кислорода и степени окисления в OF2
Брутто-формула – OF2. Молярная масса – 54 г/моль. Температура плавления равна (-223,8oС), кипения – (-144,8oС).
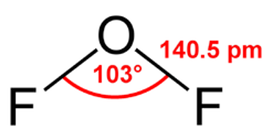
Рис. 1. Строение молекулы фторида кислорода с указанием валентного угла и длины химической связи.
В жидком состоянии хорошо растворяет воздух. Плохо растворяется в холодной воде, медленно реагируя с ней. Является сильным окислителем.
OF2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фторида кислорода, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Фтор проявляет постоянную степень окисления всегда равную (-1). Для нахождения степени окисления кислорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-1) = 0;
x -2 = 0;
x = +2.
Значит степень окисления кислорода во фториде кислорода (+2):
O+2F-12.
Примеры решения задач
| Задание | Максимальную степень окисления центральный элемент имеет в гидроксосоединении:
а) (HO)ClO2; б) (HO)3PO; в) (HO)2SO2; г) (HO)3P. |
| Решение | Для того, чтобы найти правильный ответ на поставленный вопрос будем поочередно проверять каждый из предложенных вариантов.
а) Центральным атомом является хлор. Примем значение степени окисления хлора за «х» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 1 + (-2) + х + 2×(-2) = 0; x -5 = 0; x = +5. б) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «у» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + у + (-2) = 0; y-5 = 0; y= +5. в) Центральным атомом является сера. Примем значение степени окисления серы за «z» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 2×1 + 2× (-2) + z + 2× (-2) = 0; z -6 = 0; z = +6. г) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «а» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + а = 0; a — 3 = 0; a = +3. Наименьшее значение степени окисления равно (+3), оно характерно для фосфора в соединении состава (HO)3P. |
| Ответ | Вариант (г) |
| Задание | Определите степень окисления серы в следующих соединениях: а) SO2, б) S; в) KHSO3. |
| Ответ | а)Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0; x — 4 = 0; x = +4. Степень окисления серы в диоксиде серы равна (+4): S+4O2. б) Степень окисления неметаллов в элементарном состоянии равна нулю:S0. в)Калий проявляет постоянную степень окисления, совпадающую с номером группы в Периодической системе Д.И. Менделеева, в которой он расположен, т.е. равна (+1) (калий – металл). Степень окисления кислорода в составе неорганических кислот и их остатков всегда равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности: (+1) + (+1) + х + 3×(-2) = 0; 1 + 1 + х — 6 = 0; x -4 = 0; x = +4. Степень окисления серы в гидросульфите калия равна (+4):KHS+4O3. |











