Степень окисления в NH3
Общие сведения об аммиаке и степени окисления в NH3
Брутто-формула – NH3. Молярная масса – 17 г/моль. Молекула аммиака имеет форму тригональной пирамиды (dNH = 0,10 нм, угол HNH равен 107,3o). Согласно методу валентных связей, это отвечает sp3-гибридизации валентных орбиталей атома азота (рис. 1).
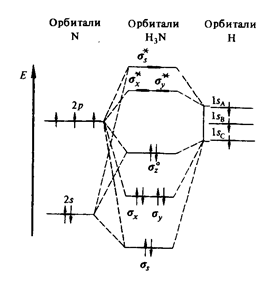
Рис. 1. Энергетическая диаграмма орбиталей молекулы аммиака.
При охлаждении до (-33,4oC) аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при (-77,8oC).
Аммиак хорошо растворим в воде: один объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH3 и имеет плотность 0,91 г/см3.Раствор аммиака в воде называют нашатырным спиртом.
NH3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав аммиака, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Аммиак – это тривиальное название гидрида азота, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
x + 3 = 0;
x = -3.
Значит степень окисления азота в аммиаке равна (-3):
N-3H+13.
Примеры решения задач
| Задание | Максимальную степень окисления центральный элемент имеет в гидроксосоединении:
а) (HO)ClO2; б) (HO)3PO; в) (HO)2SO2; г) (HO)3P. |
| Решение | Для того, чтобы найти правильный ответ на поставленный вопрос будем поочередно проверять каждый из предложенных вариантов.
а) Центральным атомом является хлор. Примем значение степени окисления хлора за «х» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 1 + (-2) + х + 2×(-2) = 0; x -5 = 0; x = +5. б) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «у» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + у + (-2) = 0; у -5 = 0; у = +5. в) Центральным атомом является сера. Примем значение степени окисления серы за «z» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 2×1 + 2× (-2) + z + 2× (-2) = 0; z -6 = 0; z = +6. г) Центральным атомом является фосфор. Примем значение степени окисления фосфора за «а» и составим уравнение электронейтральности. Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. 3×1 + 3× (-2) + а = 0; а — 3 = 0; а = +3. Наименьшее значение степени окисления равно (+3), оно характерно для фосфора в соединении состава (HO)3P. |
| Ответ | Вариант (г) |
| Задание | Наибольшую степень окисления хлор имеет в соединении: а) KClO4, б) Cl2O; в) KClO3; г)Cl2O3? |
| Решение | Определяем степень окисления хлора в каждом из указанных соединений. Сначала указываем степени окисления «известных» элементов: калий – (+1), кислород – (-2). Принимаем за «х» степень окисления хлора и записываем уравнение электронейтральности:
1 + х + (-2)×4 = 0; x -7 = 0; x = +7. Поскольку (+7) – максимально возможная степень окисления для хлора, то это и есть правильный ответ. |











