Степень окисления в PH3
Общие сведения о фосфине и степени окисления в PH3
Брутто-формула – PH3 (строение молекулы показано на рис. 1). Молярная масса фосфина равна 34,00 г/моль.
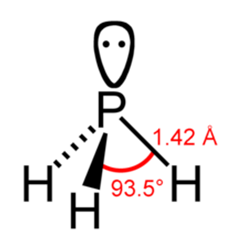
Рис. 1. Строение молекулы фосфина с указанием валентного угла и длины химической связи.
При низких температурах образует твердый кларат 8PH3×46H2O. Плотность – 1,5294 г/л. Температура кипения – (-87,42oC), плавления – (-133,8oC).
В ОВР является сильным восстановителем, окисляется концентрированной серной и азотной кислотами, йодом, кислородом, пероксидом водорода, гипохлоритом натрия. Донорные свойства выражены значительно слабее, чем у аммиака.
PH3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фосфина, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Фосфин – это тривиальное название гидрида фосфора, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления фосфора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
x + 3 = 0;
x = -3.
Значит степень окисления фосфора в фосфине равна (-3):
P-3H+13.
Примеры решения задач
| Задание | Определите степени окисления кислотообразующих элементов в следующих соединениях: HNO2, H2CO3, H4SiO4, HPO3. |
| Решение | В указанных соединениях кислотообразующими элементами являются азот, углерод, кремний и фосфор. Степень окисления кислорода равна (-2), а водорода – (+1). Примем за «х» степень окисления кислотообразующего элемента и при помощи уравнения электронейтральности найдем её значение:
1 + x + 2×(-2) = 0; x -3 = 0; x = +3. Степень окисления азота равна (+3). 2×(+1) + x + 3×(-2) = 0; x -4 = 0; x = +4. Степень окисления углерода равна (+4). 4×(+1) + x + 4×(-2) = 0; x -4 = 0; x = +4. Степень окисления кремния равна (+4). 1 + x + 3×(-2) = 0; x -5 = 0; x = +5. Степень окисления фосфора равна (+5). |
| Ответ | HN+3O2, H2C+4O3, H4Si+4O4, HP+5O3 |
| Задание | Наибольшую степень окисления железо проявляет в соединении:
|
| Решение | Для того, чтобы дать правильный ответ на поставленный вопрос будем поочередно определять степень окисления железа в каждом из предложенных соединений с помощью уравнения электронейтральности.
а) Степень окисления калия всегда равна (+1). Степень окисления углерода в цианид-ионе равна (+2), а азота – (-3). Примем за «х» значение степени окисления железа: 4×1 + х + 6×2 + 6× (-3) = 0; x -2 = 0; x = +2. б) Степень окисления калия всегда равна (+1). Степень окисления углерода в цианид-ионе равна (+2), а азота – (-3). Примем за «х» значение степени окисления железа: 3×1 + х + 6×2 + 6× (-3) = 0; x -3 = 0; x = +3. в) Степень окисления кислорода в оксидах (-2). Примем за «х» значение степени окисления железа: x + (-2) = 0; x = +2. г) Степени окисления кислорода и водорода равны (-2) и (+1) соответственно. Примем за «х» значение степени окисления железа: x + 2×(-2) + 2× 1 = 0; x -2 = 0; x = +2. Наибольшая степень окисления железа равна (+3) и её оно проявляет в соединении состава K3[Fe(CN)6]. |
| Ответ | Вариант 2 |











