Физические и химические свойства этилена
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300![]() С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
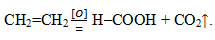
Окисление
этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150![]() C) или пропускании его паров над катализатором
C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
| Задание | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Решение |
Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании:
С2H6 →C2H4 + H2↑. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl. |
| Задание | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение |
Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола:
C2H5OH →(t, H2SO4) → C2H4 + H2O. Найдем массу этанола: m(C2H5OH) = V(C2H5OH) × ρ (C2H5OH); m(C2H5OH) = 160×0,8 = 128 г. Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола: v(C2H5OH) = m(C2H5OH)/M(C2H5OH); v(C2H5OH) = 128/46 = 2,78 моль. Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена: m(C2H4) = v(C2H4) × M(C2H4); V(C2H4) = v(C2H4) ×Vm; m(C2H4) = 2,78 × 28 = 77,84 г; V(C2H4) = 2,78 ×22,4 = 62,272 л. |
| Ответ | Масса этилена – 77,84 г, объем этилена – 62,272 л. |











