Агрегатное состояние воды
Опыт показывает, что при нагревании некоторых твёрдых тел они способны расплавляться, то есть превращаться в жидкость, а затем испаряться. Уменьшение температуры вещества ведет к обратному процессу. Возможно превращение кристаллического вещества в газ, минуя жидкую фазу (процесс сублимации).
Агрегатные состояния
Агрегатное состояние зависит от температуры и давления над поверхностью вещества. Переходы из одного агрегатного состояния в другое, которые сопровождаются изменением характера упаковки частиц (ближний, дальний порядок, неупорядоченность), называют фазовыми переходами первого рода.
В природе вода (единственное вещество на Земле) может иметь три агрегатных состояния: твердое (это дел или снег); жидкость и газообразное (пар).
Лед имеет кристаллическую решетку, то есть его атомы четко расположены. Он сохраняет форму, обладает объемом и сохраняет его, атомы плотно упакованы.
Вода текучая субстанция. Она сохраняет объем, но не сохраняет форму, принимая форму сосуда в котором находится. Имеет нечеткое расположение частиц и большую их подвижность в сравнении со льдом.
Пары воды заполняют все предоставленное им пространство, обладают рыхлой упаковкой частиц, их можно легко сжать.
В жидком состоянии вода может находиться при нормальном атмосферном давлении при температуре от 0oC до 100 oC. Вода – это растворитель, который необходим для течения биохимических реакций. Свойствами растворителя, она обладает благодаря полярности своих молекул. В массовом составе воды содержится 88,81% кислорода и 11,19% водорода. Если вода переходит изо льда в жидкость, то ее плотность растет. При увеличении температуры воды в диапазоне от 0oC до +4oC ее плотность увеличивается. С дальнейшим ростом температуры плотность воды уменьшается. При +4oC плотность воды выше, чем плотность льда. Вода имеет высокую теплоемкость (c-удельная теплоемкость): ![]() , поэтому является хорошим переносчиком тепла. Вода — тепловой регулятор на Земле. Кроме этого вода обладает высоким поверхностным натяжением (больше только у ртути).
, поэтому является хорошим переносчиком тепла. Вода — тепловой регулятор на Земле. Кроме этого вода обладает высоким поверхностным натяжением (больше только у ртути).
При давлении в одну атмосферу и температуре 0oC и ниже вода переходит в лед. Тогда как при уменьшении температуры все тела уменьшают свой объем, вода при замерзании расширяется примерно на 9%. Аномальные свойства воды объясняют особенностью молекулярного строения. Обладая одной кристаллической структурой, лед имеет много разных форм. Это снежинки, сосульки, льдины и т.д. Лед имеет высокую удельную теплоту плавления (![]() (при нормальном атмосферном давлении). Лед в природе может иметь механические примеси такие как твердые частицы, капли растворов или пузырьки газов.
(при нормальном атмосферном давлении). Лед в природе может иметь механические примеси такие как твердые частицы, капли растворов или пузырьки газов.
Переход воды в газообразное состояние можно наблюдать, нагревая при нормальном атмосферном давлении до температуры 100 oC. Газообразная вода может встречаться, например, в виде тумана, облаков.
Примеры решения задач
| Задание | Охарактеризуйте особенности фазовых переходов воды. |
| Решение | В природе существуют следующие тепловые процессы, происходящие (в том числе) с водой: нагревание (охлаждение); испарение (конденсация); плавление (отвердевание).
Будем считать, что все фазовые переходы происходят при нормальном атмосферном давлении. Тогда при При дальнейшем уменьшении давления вода не может существовать как жидкость, и лед превращается непосредственно в пар. Температура перехода льда в пар уменьшается при снижении давления. Если давление высокое, то отсутствует разница между паром и водой, при этом кипение и испарение отсутствуют. Возможно существование метастабильных состояний (перенасыщенного пара или перегретой жидкости). Эти состояния могут наблюдаться длительное время, однако они не являются устойчивыми. Диаграмма состояния приведена на рис.1. Она состоит из трех областей, которые соответствуют кристаллическому (твердому) состоянию вещества, жидкости и газообразному состоянию. Данные области разделяются кривыми, которые обозначают границы взаимно обратных процессов: 01 – плавление – кристаллизация; 02 – кипение – конденсация; 03 – сублимация – десублимация.Точка пересечения всех кривых (О) – тройная точка. 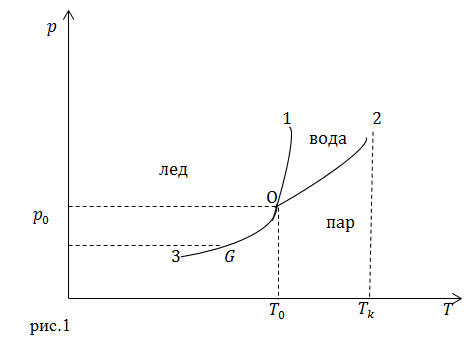
|
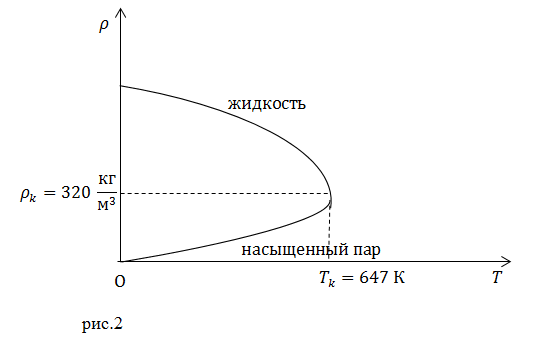
| Задание | Изобразите кривые зависимость плотности ( |
| Решение | Если на одном графике изобразить функции плотности воды от температуры и плотности пара от температуры, то для жидкости кривая будет идти вниз, а у пара вверх (рис.2). При критической температуре эти кривые сольются, что означает равенство плотностей воды и пара. Разница между агрегатными состояниями воды исчезает.
|











