Агрегатное состояние
Агрегатное состояние вещества
Агрегатное состояние вещества определяется характером взаимодействия частиц, из которых вещество состоит.
У любого вещества имеется только одно жидкое и одно газообразное состояние, кристаллических состояний может быть несколько. Причина заключается в разной степени упорядоченности упаковки в этих трех агрегатных состояниях. Газообразному состоянию вещества соответствует молекулярный беспорядок. Данному распределению молекул (атомов) соответствует большое количество разных перегруппировок молекул в пространстве. При этом физические свойства остаются при всех перегруппировках без изменения, им всем соответствует одно газообразное состояние. Жидкость характеризуется ближним порядком в упаковке молекул. В этом агрегатном состоянии вещества пространственная перегруппировка молекул не отражается на физических свойствах вещества. Следовательно, у вещества имеется только одно жидкое состояние. Иначе обстоит дело с кристаллическим состоянием вещества. В данном случае становятся возможными разные способы пространственной упаковки частиц, и они будут различаться по своим свойствам.
В твердом теле частицы, обычно, составляют правильную геометрическую структуру. Энергия тепловых колебаний частиц меньше, чем энергия их связи.
При увеличении температуры тела растет энергия тепловых колебаний частиц. Когда температура достигает такого значения, что энергия тепловых колебаний больше, чем энергия связей, связи между частицами разрушаются и образуются вновь. В этом случае частицы выполняют различные типы движений: колебания, вращения, перемещения по отношению друг к другу. Кроме того, они еще контактируют друг с другом. Правильная геометрическая структура при этом разрушена. Вещество пребывает в виде жидкости.
Дальнейший рост температуры усиливает тепловые колебания, связи между частицами ослабляются и сходят на нет. Вещество превращается в газ. Простейшей моделью вещества является идеальный газ. В нем частицы перемещаются в любых направлениях свободно, взаимодействуют друг с другом только при соударениях.
Получается, что при увеличении температуры вещество переходит от упорядоченной структуры в неупорядоченное состояние.
И так, при нагревании твердого тела оно плавится, а потом испаряется. Охлаждение вещества ведет к обратному процессу. Случается, что рост температуры приводит к испарению кристалла без перехода его в жидкую фазу.
Агрегатное состояние вещества зависит от его температуры, а также давления над его поверхностью.
Фазовые переходы из одного агрегатного состояния в другое
Переходы вещества из одного агрегатного состояния в другое, которое сопровождается изменением характера расположения и взаимодействия частиц, называют фазовыми переходами первого рода.
Фазовые переходы второго рода отличаются тем, что в них изменяются некоторые свойства вещества, но характер упаковки частиц остается неизменным.
Тело может получить теплоту фазового перехода за счет теплообмена с окружающей средой. В этом случае фазовый переход происходит при неизменной температуре. Эта температура зависит от давления. Температуру фазового перехода часто находят при помощи диаграммы состояний.
Если энергии за счет теплообмена мало, то теплота фазового перехода может быть получена только за счет изменения энергии молекулярного движения, что ведет к изменению температуры тела.
При обратных процессах (конденсация пара в жидкость или кристаллизация расплавленного вещества) внутренняя энергия уменьшается и теплота фазового перехода выделяется.
При фазовых переходах изменяется энергия каждой молекулы вещества. Если обозначить изменение энергии одной молекулы при фазовом переходе как ![]() , а число молекул как N, то получим:
, а число молекул как N, то получим:
![]()
где ![]() – теплота фазового перехода;
– теплота фазового перехода; ![]() – масса вещества;
– масса вещества; ![]() – удельная теплота фазового перехода.
– удельная теплота фазового перехода.
Примеры решения задач
| Задание | Объясните, почему удельная теплота парообразования много больше, чем удельная теплота плавления. |
| Решение | Расстояния между частицами при плавлении вещества изменяются незначительно в сравнении с расстояниями между ними же в кристалле. При процессе испарения расстояния между молекулами увеличиваются примерно в десять раз по сравнению, чем расстояния между теми же молекулами в твердом или даже жидком веществе. Отсюда следует, что теплота парообразования должна быть существенно больше, чем удельная теплота плавления. Например, для льда при нормальном атмосферном давлении, удельная теплота плавления составляет |
| Задание | Процессы, которые происходят с водой, изображены на графике (рис.1). Что это за процессы? Какое количество теплоты следует сообщить воде массы 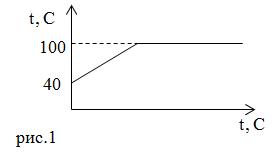
|
| Решение | На рис.1 изображены два процесса, происходящие с водой – это нагревание ее от Для нагрева воды требуется количество теплоты равное: где Для перевода всей массы воды в пар при температуре кипения требуется затратить количество теплоты равное: где Проведем вычисления: |
| Ответ |











