Строение молекулы воды
Общие сведения о строении молекулы воды
Вода – термодинамически устойчивое соединение. Стандартная энергия Гиббса образования жидкой воды при температуре 298 Л рана – 237, 57кДж/моль, водяного пара – 228,94 кДж/моль. В этой связи константа диссоциации водяного пара на водород и кислород очень мала (8,88×10-41).
Агрегатное состояние воды определяется температурой и давлением (рис. 1). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
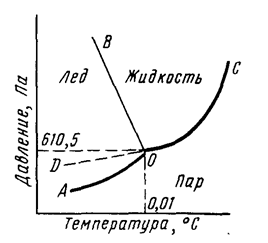
Рис. 1. Диаграмма состояния воды.
Электронное строение молекулы воды
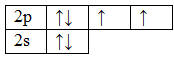
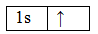
Структурная молекула воды имеет вид H2O. Запишем электронные конфигурации атомов кислорода и водорода в основном состоянии, а затем зарисуем их электронно-графические формулы:
8О 1s22s22p4
1H 1s1
При образовании молекулы воды электронные облака двух неспаренных 2p-электронов атома кислорода перекрываются с 1s-электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 2. Поскольку p-электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула воды имеет угловое строение, причем можно ожидать, что угол между связями О-Н будет составлять 90o.
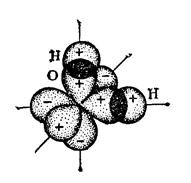
Рис. 2. Схема строения молекулы воды.
Однако, на деле валентный угол между атомами кислорода и водорода отличается от 90o, он составляет 104,5o.
Примеры решения задач
| Задание | Напишите уравнения реакций между водой и следующими веществами: а) кальцием; б) оксидом углерода (IV); в) железом при нагревании); г) оксидом серы (VI); д) оксидом кальция. |
| Ответ | При растворении кальция в воде происходит образование мутного раствора белого цвета (гидроксид кальция) и выделение пузырьков газа (водород):
Ca + 2H2O = Ca(OH)2 + H2↑. При растворении оксида углерода (IV) в воде происходит образование угольной кислоты. Это обратимая реакция: CO2 + H2O ↔ H2CO3. При взаимодействии раскаленного железа с водяным паром протекает химическая реакция, уравнение которой имеет вид: 3Fe + 4H2O = Fe3O4+ 4H2↑. При пропускании оксида серы (VI) через воду происходит образование серной кислоты: SO3 + H2O = H2SO4. При растворении оксида кальция в воде происходит образование гидроксида кальция. Реакция сопровождается выделением тепла (экзотермическая): CaO + H2O = Ca(OH)2 + Q. |
| Задание | Какая масса водорода выделится, если в воду добавить 1г кальция? | |
| Решение | Запишем уравнение реакции растворения кальция в воде:
Ca + 2H2O = Ca(OH)2 + H2↑. Рассчитаем количество вещества кальция, вступившего в реакцию (молярная масса – 40 г/моль): n = m / M; n(Ca) = m(Ca) / M(Ca); n(Ca) = 1 / 40 = 0,025 моль. Согласно уравнению реакции n(Ca) : n(H2) = 1 : 1, т.е. n(Ca) = n(H2) = 0,025 моль. Тогда, масса выделившегося водорода будет равна (молярная масса – 2 г/моль): m = n × M; m(H2) = n (H2)× M (H2); m(H2) = 0,025 × 2 = 0,05 г. |
|
| Ответ | Масса водорода равна 0,05 г. |











