Степень окисления в HCl
Общие сведения о соляной кислоте и степени окисления в HCl
Полученный раствор является сильной кислотой (35-36%). Брутто-формула – HCl. Молярная масса – 36,46 г/моль. Плотность – 1,6391 г/л (н.у.). Температура плавления равна – (-114,0oC), кипения – (-85,05oC).
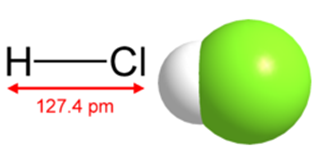
Рис. 1. Структурная формула и пространственное строение молекулы хлороводорода.
В ОВР проявляет свойства восстановителя (за счет ионов Cl—) и окислителя (за счет ионов H+). Строение молекулы хлороводорода, а также её структурная формула приведены на рис. 1.
HCl, степени окисления элементов в ней
Чтобы определить степени окисления элементов, входящих в состав хлороводородной (соляной) кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления водорода в составе неорганических кислот всегда равна (+1). Для нахождения степени окисления хлора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
(+1) + х = 0;
1 + х = 0;
x = -1.
Значит степень окисления хлора в хлороводородной кислоте равна (-1):
H+1Cl-1.
Примеры решения задач
| Задание | В соединениях NH3, N2O3и HNO2степень окисления азота соответственно равна:
|
| Решение | Определим степени окисления азота в предложенных соединениях. Укажем степени окисления для известных элементов: водород – (+1), кислород – (-2). Составим уравнения электронейтральности обозначив за «х» значение степени окисления азота:
x + 3×1 = 0; x = -3. 2×у + 3×(-2) = 0; 2у = +6; y = +3. 1 + z + 2×(-2) = 0; z -3 = 0; z = +3. Верная последовательность значений степеней окисления азота в предложенных соединениях: (-3), (+3), (+3). |
| Ответ | Вариант 1 |
| Задание | Составьте формулы соединения с водородом следующих элементов (в скобках указаны степени окисления элементов): а) мышьяка (+3); б) кремния (+4); в) германия (+4); г) йода (-1); д) селена (-2). |
| Решение | Известно, что в соединениях с металлами водород проявляет степень окисления (-1), а в соединениях с неметаллами — (+1).
Для того, чтобы составить формулу соединения запишем обозначения химических элементов и укажем степени их окисления: As+3H-1. Затем найдем наименьшее общее кратное (знак «-» или «+» не учитываем): 1 × 3 = 3. Разделим полученное значение на величину степени окисления, а полученные цифры запишем в виде индексов, указывающих количество атомов каждого элемента в составе молекулы: 3/3 =1; 3/1 = 3; AsH3. Аналогичным образом составляем формулы других соединений указанных элементов с водородом: SiH4, GeH4, HI, H2Se. |
| Ответ | а) AsH3; б) SiH4; в) GeH4; г) HI; д) H2Se |











