Азотная кислота
Характеристики и физические свойства азотной кислоты
На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары её образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влияние света она постепенно разлагается:
4HNO3 = 4NO2↑ + O2↑ + 2H2O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
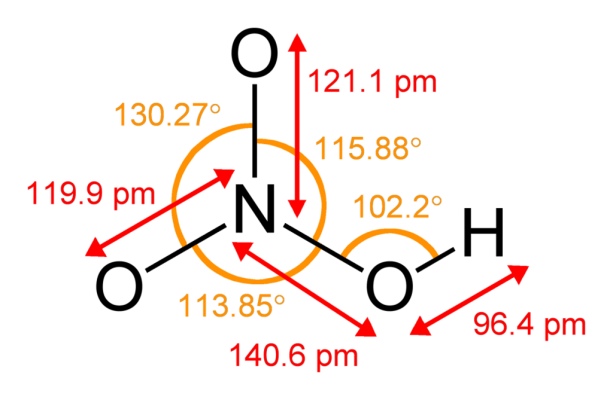
Рис. 1. Строение молекулы азотной кислоты.
Таблица 1. Физические свойства азотной кислоты.
|
Молекулярная формула |
HNO3 |
|
Молярная масса, г/моль |
63 |
|
Плотность, г/см3 |
1,513 |
|
Температура плавления, oС |
-41,59 |
|
Температура кипения, oС |
82,6 |
|
Растворимость в воде, г/100мл |
смешивается |
Получение азотной кислоты
Азотная кислота образуется в результате действия окислителей на азотистую кислоту:
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O.
Безводная азотная кислота может быть получена перегонкой при пониженном давлении концентрированного раствора азотной кислоты в присутствии P4O10 или H2SO4 в полностью стеклянном оборудовании без смазки в темноте.
Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака над нагретой платиной:
NH3 + 2O2 = HNO3 + H2O.
Химические свойства азотной кислоты
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO3↔H+ + NO3—.
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота – один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор – в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO3, ярко разгорается.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы – в оксиды.
Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов – железа, цинка – образуется оксид диазота. Сильно разбавленная азотная кислота взаимодействует с активными металлами – цинком, магнием, алюминием – с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Cu + HNO3 (conc) = Cu(NO3)2 + NO2↑ + H2O;
Cu + HNO3 (dilute) = Cu(NO3)2 + NO↑ + H2O;
Mg + HNO3 (dilute) = Mg(NO3)2 + N2O↑ + H2O;
Zn + HNO3 (highly dilute) = Zn(NO3)2 + NH4NO3 + H2O.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl.
Применение азотной кислоты
Азотная кислота – одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Примеры решения задач
| Задание | Вычислите рН 6,3×10-5М раствора азотной кислоты. |
| Решение | Известно, что водородный показатель вычисляется по формуле
pH = -lg[H+]. При вычислении пользуемся таблицами четырехзначных логарифмов: рН = -lg(6,3×10-5) = 5 – 0,7993 = 4,2007. В нестепенном члене логарифмического числа содержатся две значащие цифры, поэтому округляем мантиссу до двух цифр: рН = 4,20. |
| Ответ | pН раствора азотной кислоты равен 4,20. |
| Задание | Составьте уравнение электронейтральности для водного раствора нитрата калия. |
| Ответ | В водном растворе нитрата калия (KNO3 – калиевая соль азотной кислоты) имеются ионы K+, NO3— и ионы H3O+ и OH—, образующиеся при диссоциации воды. Уравнение электронейтральности поэтому следует записать так:
[K+] + [H3O+] = [NO3—] + [OH—]. |











