Азотистая кислота
Характеристики и физические свойства азотистой кислоты
Она имеет две таутомерные формы: NO(OH) и N(H)O2(преобладает при комнатной температуре в растворе). Концентрированные растворы – голубые, разбавленные растворы – бесцветные. В форме NO(OH) проявляет слабые кислотные свойства, в форме N(H)O2 кислотой не является.
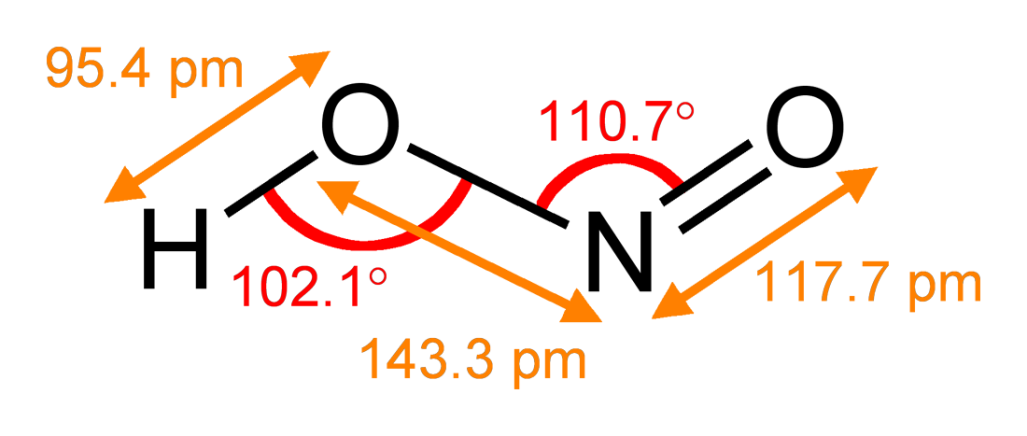
Рис. 1. Строение молекулы азотистой кислоты.
Таблица 1. Физические свойства азотистой кислоты.
|
Молекулярная формула |
HNO2 |
|
Молярная масса, г/моль |
47 |
|
Плотность, г/см3 |
1, 685 |
|
Температура плавления, oС |
42,35 |
|
Температура кипения, oС |
158 |
|
Растворимость в воде, г/100мл |
548 |
Получение азотистой кислоты
При действии разбавленной серной кислоты на раствор какого-нибудь нитрита происходит образование свободной азотистой кислоты:
2NaNO2 + H2SO4 = Na2SO4 + 2HNO2.
Химические свойства азотистой кислоты
Азотистая кислота в водном растворе диссоциирует на ионы. Её соли носят название нитриты.
HNO2↔H+ + NO2—.
Азотистая кислота нейтрализуется щелочами (1), гидратом аммиака (2):
HNO2 + NaOHdilute = NaNO2 + H2O (1);
HNO2 + NH3×H2Oconc., cold = NH4NO2 + H2O (2).
Реагирует с атомным водородом (3), кислородом (4), пероксидом водорода (5, 6):
HNO2 + HCldilute + H0(Zn) = NH4Cl + 2H2O (3);
HNO2 + O2 = 2HNO3 (4);
HNO2 + H2O2 (conc)↔ HNO(O22-) + H2O (t = 0oC) (5);
HNO2 + H2O2 (conc) = HNO3 + H2O (6).
Проявляет окислительно-восстановительные свойства (7 — 10):
HNO2 (conc) + N2H4 = HN3 + 2H2O (7);
HNO2 + NH2OH = H2N2O2 + H2O (87);
3HNO2 + 3H2SO4 + 6FeSO4 (conc) = N2↑ + 3Fe2(SO4)3 + 4H2O (9);
5HNO2 (conc) + HNO3 (dilute) + 2KMnO4 = 2Mn(NO3)2 + 2KNO3 + 3H2O (10).
Применение азотистой кислоты
Азотистая кислота нашла применение в органическом синтезе, в частности, для получения ароматических аминов и солей диазония.
Примеры решения задач
| Задание | Термодинамическая константа кислотности азотистой кислоты равна 6,2×10-4. Рассчитайте реальную константу в растворе с ионной силой 0,01. |
| Решение | В таблицах находим значения коэффициентов активности ионов H+ и NO2— при ионной силе 0,01:
γ(H+) = γ(NO2—) = 0,89. Коэффициент активности молекул азотной кислоты равен единице. K0 = a(H+)×a(NO2—) / a(HNO2) = [H+]×[NO2—] / [HNO2] × γ(H+)× γ(NO2—). Отсюда K = [H+]×[NO2—] / [HNO2] = K0 / γ(H+)×γ(NO2—); K = 6,2×10-4 / (0,89)2 = 7,8×10-4. |
| Ответ | Реальная константа кислотности азотистой кислоты равна 7,8×10-4. |
| Задание | Вычислите рН и рОН раствора азотистой кислоты, если концентрация ионов водорода H+ в растворе равна 10-7М. Укажите реакцию среды. |
| Решение | Известно, что водородный показатель вычисляется по формуле
pH = -lg[H+]. Найдем рН раствора азотистой кислоты: pH = -lg(10-7) = 7,00. Для расчета показателя основности раствора используют следующую формулу: pOH = 14 – pH, т.е. pOH = 14 – 7,00 = 7,00. Среда раствора – нейтральная. |
| Ответ | pH = 7,00; рОН = 7,00; среда – нейтральная. |











