Хлорная кислота
Характеристики и физические свойства хлорной кислоты
Очень чувствительная к примесям. Неограниченно смешивается с водой. Сильная кислота. Концентрированные растворы маслообразны. Перегоняется в вакууме (72%-ный раствор, температура кипения 111oС). Проявляет свойства слабого окислителя в разбавленном и сильного окислителя в концентрированном растворе при нагревании.
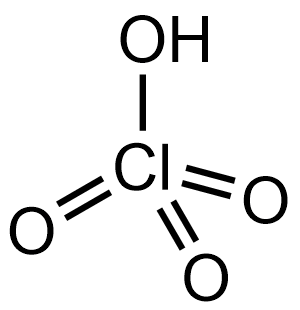
Рис. 1. Строение молекулы хлорной кислоты.
Таблица 1. Физические свойства хлорной кислоты.
|
Молекулярная формула |
HClO4 |
|
Молярная масса, г/моль |
100,5 |
|
Плотность, г/см3 |
1,76 |
|
Температура плавления, oС |
-101 |
|
Температура кипения, oС |
120,5 |
Получение хлорной кислоты
Свободная хлорная кислота может быть получена при действии серной кислоты на перхлорат калия:
KClO4 + H2SO4 = HClO4 + KHSO4.
Химические свойства хлорной кислоты
Хлорная кислота в водном растворе диссоциирует на ионы:
HClO4↔ H+ + ClO4—.
Если нагревать хлорную кислоту с оксидом фосфора (V), отнимающим от неё воду, то образуется оксид хлора (VII), или хлорный ангидрид Cl2O7:
2HClO4 + P2O5 = 2HPO3 + Cl2O7.
Хлорная кислота растворяет серебро, золото и металлы платиновой группы:
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O.
В реакциях нейтрализации со щелочами хлорная кислота образует соли – перхлораты:
HClO4 + NaOHdilute = NaClO4 + H2O;
HClO4 (dilute, cold) + KOH = KClO4 + H2O.
Применение хлорной кислоты
Хлорная кислота нашла ограниченное применение в химическом анализе, в частности в аналитической химии при получении перхлоратов.
Примеры решения задач
| Задание | Какая масса перхлората серебра образуется при растворении чистого металла в растворе хлорной кислоты (230 г 15%-ный)? |
| Решение | Запишем уравнение реакции взаимодействия хлорной кислоты с серебром, в результате которого происходит образование перхлората серебра:
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O. Найдем массу хлорной кислоты в растворе: ω = msolute / msolution × 100%; msolute = ω / 100% × msolution; msolute (HClO4) = ω (HClO4) / 100% × msolution; msolute (HClO4) = 15 / 100% × 230 = 34,5 г. Рассчитаем количество моль хлорной кислоты (молярная масса равна 100,5 г/моль): n = m / M; n(HClO4) = m (HClO4) / M (HClO4); n (HClO4) = 34,5 / 100,5 = 0,34 моль. Согласно уравнению реакции n (HClO4) : n (AgClO4) = 3: 2. Значит, n(AgClO4) = 2/3 × n(HClO4) = 2/3 × 0,34 = 0,23моль. Тогда масса образовавшегося перхлората серебра будет равна (молярная масса – 207 г/моль): m = n × M; m (AgClO4) = n (AgClO4)× M (AgClO4); m (AgClO4) = 0,23× 207 = 47,61г. |
| Ответ | Масса перхлората серебра равна 47,61 г. |
| Задание | Вычислите рН и рОН раствора хлорной кислоты, если концентрация ионов водорода H+ в растворе равна 10-3М. Укажите реакцию среды. |
| Решение | Известно, что водородный показатель вычисляется по формуле
pH = -lg[H+]. Найдем рН раствора хлорной кислоты: pH = -lg(10-3) = 3,00. Для расчета показателя основности раствора используют следующую формулу: pOH = 14 – pH, т.е. pOH = 14 – 3,00 = 11,00. Среда раствора – кислая. |
| Ответ | pH = 3,00; рОН = 11,00; среда – кислая. |











