Плотность соляной кислоты
Плотность соляной кислоты и другие её физические свойства
В обычных условиях представляет собой бесцветную едкую жидкость с резким запахом, «дымящуюся» на воздухе. Её пары ядовиты и вызывают ожоги дыхательных путей.
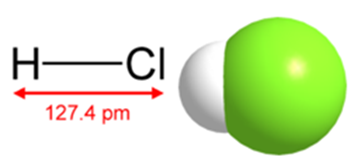
Рис. 1. Строение молекулы соляной кислоты.
Физические свойства и плотность соляной кислоты сильно зависят от её концентрации.
|
Концентрация, % |
Плотность, кг/л |
Вязкость, МПа×с |
Температура, oС |
|
|
кипения |
плавления |
|||
|
10 |
1,048 |
1,16 |
103 |
-18 |
|
20 |
1,098 |
1,37 |
108 |
-59 |
|
30 |
1,149 |
1,70 |
90 |
-52 |
|
32 |
1,159 |
1,80 |
84 |
-43 |
|
34 |
1,169 |
1,90 |
71 |
-36 |
|
36 |
1,179 |
1,99 |
61 |
-30 |
|
38 |
1,189 |
2,10 |
48 |
-26 |
Соляная кислота – сильная одноосновная кислота. Несмотря на общепринятое мнение о том, что жидкий хлороводород имеет такое тривиальное название, только 35—36%-й раствор называют соляной кислотой, а 20—24%-й и 7—10%-й растворы — соответственно концентрированной и разбавленной хлороводородной кислотой.
Она реагирует с концентрированной азотной кислотой («царская водка»); нейтрализуется щелочами, гидратом аммиака. В окислительно-восстановительных реакциях проявляет свойства, как восстановителя за счет образования иона Cl—, так и окислителя – H+.
6HClconc + 2HNO3 (conc) = 2NO + 3Cl2 + 4H2O (t = 100 – 150oC);
HCldilute + NaOHdilute = NaCl + H2O;
4HCl + O2 = 2H2O + Cl2 (t < 600oC, kat. CuCl2);
2HCl + F2 = 2HF + Cl2;
2HClgas + Fe = FeCl2 + H2 (t = 600 – 700oC);
4HClconc + PbO2 = PbCl2 + Cl2 + 2H2O;
16HClconc + 2KMnO4 = 2MnCl2 + 5Cl2 + 8H2O + 2KCl;
14HClconc + K2Cr2O7 = 2CrCl3 + 3CrCl3 + 3Cl2 + 7H2O + 2KCl (t = 60 – 80oC).
Примеры решения задач
| Задание | Плотность газа по воздуху равна 2,14. Рассчитайте массу газа объемом 1 л (н.у.). |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа: M1 = D×M2. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Тогда, молярная масса газа будет равна: Mgas = Dair× M(air) = 2,14× 29 = 62,06г/моль. Массу газа можно рассчитать по формуле: m(gas) = n(gas) ×Mgas. Найдем количество вещества газа: V(gas) = n(gas) ×Vm; n(gas) = V(gas) / Vm = 1 / 22,4 = 0,04 моль. Тогда, m(gas) = 0,04 ×62,06 = 2,48 г. |
| Ответ | Масса газа равна 2,48 г. |
| Задание | Образец газа массой 1,525 г занимает при нормальных условиях объем, равный 0,7 л. Рассчитайте молярную массу газа. |
| Решение | Массу газа можно рассчитать по формуле:
m(gas) = n(gas) ×Mgas. Найдем количество вещества газа: V(gas) = n(gas) ×Vm; n(gas) = V(gas) / Vm = 0,7 / 22,4 = 0,03 моль. Тогда, молярная масса газа будет равна: Mgas = m(gas) / n(gas) = 1,525 / 0,03 = 51 г/моль. |
| Ответ | Молярная масса газа равна 51 г/моль. |











