Плотность серной кислоты
Плотность серной кислоты и другие её физические свойства
В водных растворах она ведет себя как сильнейшая двухосновная кислота. Химическое строение молекулы H2SO4 отвечает искаженному тетраэдру (рис. 1). В еще большей степени искажение в гидросульфат-ионе HSO4—. Сульфат-ион SO42- имеет форму правильного тетраэдра; все расстояния и углы между связями в нем равноценны.
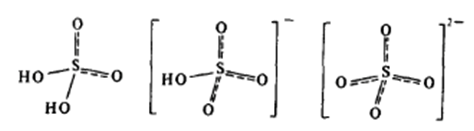
Рис. 1. Строение молекулы серной кислоты и образуемых ей ионов.
Серная кислота гигроскопична. Она легко переохлаждается до 0oС. При нагревании частично разлагается (выделяется SO3), перегоняется в виде азеотропной смеси, массовая доля серной кислоты в которой составляет 98,3%. При более высоких температурах разлагается полностью. Неограниченно смешивается с водой.
Важнейшие характеристики серной кислоты приведены в таблице ниже.
Таблица 1. Физические свойства и плотность серной кислоты.
|
Плотность, г/см3 |
1,8356 |
|
Температура плавления, oС |
10,30 |
|
Температура кипения, oС |
337 |
|
Динамическая вязкость, Па×с |
0,027534 |
|
Кинетическая вязкость (20oС), см2/с |
0,501 |
|
pKa |
-3 |
Краткая характеристика химических свойств и плотность серной кислоты
Концентрированная серная кислота – сильный окислитель. В зависимости от силы восстановителя она может быть восстановлена до диоксида серы, серы и сероводорода.
Серная кислота вступает в реакции обмена, нейтрализуется щелочами. В концентрированном растворе серной кислоты некоторые металлы (Be, Bi, Co, Fe, Mg, Nb) пассивируются.
H2SO4(conc., cold) + NaOH = NaHSO4 + H2O;
H2SO4(dilute) + 2NaOH = Na2SO4 + 2H2O;
H2SO4(dilute) + CaO = CaSO4 + 2H2O;
H2SO4(dilute) + Ca(OH)2 = CaSO4 + 2H2O;
H2SO4 + Ba(NO2)2 = 2HNO2 + BaSO4;
H2SO4(conc.) + NaClsolid = NaHSO4 + HCl;
H2SO4(conc.) + 2NaClsolid = NaSO4 + 2HCl;
5H2SO4(conc.) + 4Zn = 4ZnSO4 + H2S + 4H2O;
2H2SO4(conc.) + Cu = CuSO4 + SO2 + 2H2O;
2H2SO4(conc.) + 2Ag = Ag2SO4 + SO2 + 2H2O;
2H2SO4(conc., hot) + 2Hg = Hg2SO4 + SO2 + 2H2O.
Безводная серная кислота – неводный растворитель для сульфатов металлов.
Примеры решения задач
| Задание | Плотность простого вещества газа фтора по воздуху равна 1,31. Вычислите молярную массу фтора и его формулу. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа.
D = M1 / M2. Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа: M1 = D×M2. Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Тогда, молярная масса газа фтора будет равна: Mgas = Dair× M(air) = 1,31 × 29 = 37,99 г/моль. Относительная атомная масса фтора равна 18,9984 а.е.м. Тогда, в состав молекулы фтора входит Mgas /Ar(F) атомов фтора: Mgas / Ar(F) = 37,99 / 18,9984 = 2. Значит формула молекулы фтора F2. |
| Ответ | Молярная масса фтора равна 37,99 г/моль, а формула молекулы фтора F2. |
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: иодоводорода HI и оксида азота (I). |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов. Mr(HI) = Ar(H) + Ar(I) = 1 + 127 = 128. Dair(HI) = Mr(HI) / Mr(air) = 128 / 29 = 4,41; DO2(HI) = Mr(HI) / Mr(O2) = 128 / 32 = 4; DN2(HI) = Mr(HI) / Mr(N2) = 128 / 28 = 4,57. Mr(O2) = 2 ×Ar(O) = 2 × 16 = 32. Mr(N2) = 2 ×Ar(N) = 2 × 14 = 28. Mr(N2O) = 2 ×Ar(N) + Ar(O) = 2 ×14 + 16 = 28 + 16 = 44. Dair(N2O) = Mr(N2O) / Mr(air) = 44 / 29 = 1,52; DO2(N2O) = Mr(N2O) / Mr(O2) = 44 / 32 = 1,375; DN2(N2O) = Mr(N2O) / Mr(N2) = 44 / 28 = 1,57. |
| Ответ | Плотности иодоводорода по воздуху, кислороду и азоту соответственно равны 4,41, 4 и 4,57; плотности оксида азота (I) по воздуху, кислороду и азоту соответственно равны 1,52, 1,375 и 1,57. |











