Гидролиз нитрата аммония
Общие сведения о гидролизе нитрата аммония
Представляет собой вещество белого цвета кристаллического строения. Молярная масса – 80 г/моль.
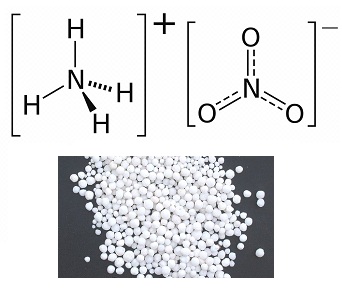
Рис. 1. Нитрат аммония. Внешний вид и структурная формула.
Гидролиз нитрата аммония
Гидролизуется по катиону. Характер среды – кислый. Уравнение гидролиза имеет следующий вид:
NH4NO3 ↔ NH4+ + NO3— (диссоциация соли);
NH4+ + HOH ↔ NH4OH + H+ (гидролиз по катиону);
NH4+ + NO3— + HOH ↔ NH4OH + NO3— + H+ (ионное уравнение);
NH4NO3 + H2O ↔ NH4OH +HNO3 (молекулярное уравнение).
Примеры решения задач
| Задание | Какой объем аммиака потребуется для получения 15 г нитрата аммония? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты:
NH3 + HNO3 = NH4NO3. Рассчитаем количества вещества нитрата аммония (молярная масса – 80/моль): υ = m/ M; υ(NH4NO3) = m (NH4NO3)/M(NH4NO3) = 15/80= 0,2моль. Согласно уравнению реакции υ(NH4NO3) = υ(NH3) =0,2 моль. Тогда можно рассчитать объем аммиака, который потребуется для осуществления данной реакции: V = Vm× υ; V (NH3)=Vm× υ(NH3) = 22,4×0,2 =4,48л. |
| Ответ | Для получения искомой массы нитрата аммония потребуется 4,48 л аммиака. |
| Задание | В каком количестве можно получить нитрат аммония (г) при взаимодействии аммиака массой 5,4 г с азотной кислотой? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты:
NH3 + HNO3 = NH4NO3. Найдем количество вещества аммиака используя данные, указанные в условии задачи (молярная масса – 17 г/моль): υ = m/ M; υ(NH3) = m (NH3)/M(NH3) = 5,4/14= 0,32 моль. Согласно уравнению реакции υ(NH3) = υ(NH4NO3) = 0,32 моль. Тогда можно рассчитать массу образовавшегося в ходе реакции нитрата аммония(молярная масса – 80/моль): m= υ×M; m(NH4NO3)= υ(NH4NO3)×M(NH4NO3)= 0,32×80 = 25,6 г |
| Ответ | Масса образующегося в ходе реакции нитрата аммония равна 25,6 г. |











