Физические и химические свойства кислорода
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
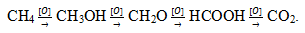
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
| Задание | При разложении 95 г оксида ртути (II) образовалось 4,48 л кислорода (н.у.). Вычислите долю разложившегося оксида ртути (II) (в мас. %). |
| Решение |
Запишем уравнение реакции разложения оксида ртути (II):
2HgO = 2Hg + O2. Зная объем выделившегося кислорода, найдем его количество вещества:
Согласно уравнению реакции n(HgO):n(O2) = 2:1, следовательно, n(HgO) = 2×n(O2) = 0,4 моль. Вычислим массу разложившегося оксида. Количество вещества связано с массой вещества соотношением: Молярная масса (молекулярная масса одного моль) оксида ртути (II), рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 217 г/моль. Тогда масса оксида ртути (II) равна: m (HgO) = n (HgO) ×M (HgO) = 0,4×217 = 86,8 г. Определим массовую долю разложившегося оксида: |
| Ответ | Массовая доля оксида ртути (II) равна 88,9%. |
| Задание | Вычислите, какое количество теплоты выделится при сжигании 100 л водорода (н.у.). Термохимическое уравнение реакции: 2H2+O2 = 2H2O+572 кДж. |
| Решение |
Еще раз запишем уравнение реакции:
2H2+O2 = 2H2O+572 кДж. Вычислим количество вещества водорода: n(H2) = 100/22,4 = 4,46 моль. Количество вещества связано с его массой формулой: Молярная масса (молекулярная масса одного моль) водорода, рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 2 г/моль. Тогда водорода равна: m (H2) = n (H2) ×M (H2) = 4,46×2 = 8,92 г. Количество вещества водорода, согласно термохимическому уравнению равно 2 моль, тогда, его теоретическая масса будет равна 4 г. Составим пропорцию: 8,92 г Н2 – Q кДж тепла 4 г Н2 – 572 кДж тепла. Найдем, количество теплоты, выделившееся при сжигании 100 л водорода: Q = (572 × 8,92)/4 = 1275,56 кДж. |
| Ответ | Количество теплоты, выделившееся при сжигании 100 л водорода — 1275,56 кДж. |











