Формула сульфида аммония
Определение и формула сульфида аммония
В растворе смесь сульфид аммония имеет окраску от желтой до красной. На воздухе раствор мутнеет. Хорошо растворяется в разбавленном растворе аммиака, плохо — в концентрированном растворе (при комнатной температуре сохраняется под ним длительное время без разложения). Разлагается кислотами. Обладает окислительным действием.

Рис. 1. Сульфид аммония. Внешний вид.
Химическая формула сульфида аммония
Химическая формула сульфида аммония имеет вид (NH4)2S. Она показывает, что в состав данной молекулы входят два атома азота (Ar = 14 а.е.м.), восемь атомов водорода (Ar = 1 а.е.м.) и один атом серы (Ar = 32 а.е.м.). По химической формуле можно вычислить молекулярную массу сульфида аммония:
Mr((NH4)2S) = 2×Ar(N) + 8×Ar(H) + Ar(S);
Mr((NH4)2S) = 2×14 + 8×1 + 32 = 28 + 8 + 32 = 68.
Графическая (структурная) формула сульфида аммония
Структурная (графическая) формула является более наглядной, она отражает то, как атомы связаны между собой внутри молекулы сульфида аммония (рис. 2).
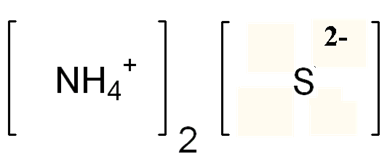
Рис. 2. Графическая формула сульфида аммония.
Ионная формула
Сульфид аммония – электролит. В водном растворе под действием электрического тока он частично диссоциирует на ионы согласно следующему уравнению:
(NH4)2S↔2NH4+ + S2-.
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно:
CxHy+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [14,8 / 44]×12 = 4,04 г; m(H) = 2×3,6 / 18 ×1= 0,4 г. Определим химическую формулу углеводорода: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y= 4,04/12 :0,4/1 x:y= 0,34 : 0,4 = 1 : 1. Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 39 = 78 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH) = 78 / 13 = 6. Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол. |
| Ответ | C6H6 |
| Задание | При сжигании 26,7 г аминокислоты (CxHyOzNk) в избытке кислорода образуется 39,6 г оксида углерода (IV), 18,9 г воды и 4,2 г азота. Определите формулу аминокислоты. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно:
CxHyOzNk+ Oz→CO2 + H2O + N2. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м., Ar(N) = 14 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [39,6 / 44]×12 = 10,8 г; m(H) = 2×18,9 / 18 ×1= 2,1 г. m(O) = m(CxHyOzNk) – m(C) – m(H) – m(N)= 26,7 – 10,8 – 2,1 – 4,2 = 9,6 г. Определим химическую формулу аминокислоты: x:y:z:k = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O) : m(N)/Ar(N); x:y:z:k= 10,8/12 :2,1/1 :9,6/16 : 4,2/14; x:y:z:k= 0,9 : 2,1 : 0,41 : 0,3 = 3: 7 : 1,5 : 1 = 6 : 14: 3 : 2. Значит простейшая формула аминокислоты C6H14O3N2. |
| Ответ | C6H14O3N2 |











