Формула кремния
Определение и формула кремния
Плавится с уменьшением объема. Устойчив на воздухе (образование защитной оксидной пленки). В кристаллической форме — малореакционноспособный; не реагирует с водой, кислотами (включая и фтороводородную кислоту), водородом. В аморфной форме — более активный; реагирует с концентрированной фтороводородной кислотой, щелочами (частично переводится в раствор даже в слабощелочной среде), поглощает значительные количества различных газов(в том числе водород).
Окисляется кислородом, галогенами, реагирует с галогеноводородами, аммиаком, сероводородом, сульфидами металлов при нагревании.

Рис. 1. Кремний. Внешний вид.
Химическая формула кремния
Химическое обозначение кремния – Si от латинского слова «silicium». Этот химический элемент расположен в третьем периоде в IVА группе Периодической таблицы Д.И. Менделеева. Относится к элементамр-семейства. Неметалл. Относительная атомная масса натрия равна 28,086 а.е.м.
Электронная формула кремния
В ядре атома кремния содержится 14 протонов и 14 нейтронов (массовое число равно 28). В атоме кремния есть три энергетических уровня, на которых находятся 14 электронов (рис. 2).
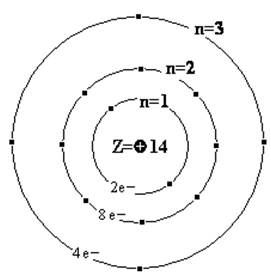
Рис. 2. Строение атома кремния.
Электронная формула атома кремния в основном состоянии имеет следующий вид:
+14 Si)2)8)4;
1s22s22p63s23p2.
Примеры решения задач
| Задание | При сгорании 7 г органического вещества получили 11,2 л (н.у.) CO2 и 9 г H2O. Относительная плотность вещества по кислороду равна 1,313. Найдите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz →CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)]×M(H). Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×9 / 18] ×1 = 1 г. Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y =6/12 :1/1; x:y = 0,5 : 1 = 1: 2. Значит простейшая формула соединения CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H)= 12 + 2×1 = 14 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду: Msubstance = M(O2) × D(O2); Msubstance = 32 × 1,313 = 42 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH2) = 42 / 14 = 3. Значит индексы атомов углерода и водорода должны быть в 3 раза выше, т.е. формула вещества будет иметь вид C3H6. |
| Ответ | C3H6 |
| Задание | При сжигании 3,5 г газа образовалось 11 г углекислого газа и 4,5 г воды. Один литр этого газа (н.у.) имеет массу 1,25 г. Определите молекулярную формулу этого газа. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [11 / 44]×12 = 3 г; m(H) = 2×4,5 / 18 ×1= 0,5 г. m(O) = m(CxHyOz) – m(C) – m(H) = 3,5 – 3 – 0,5 = 0 г. Значит в составе газа нет кислорода. Определим простейшую химическую формулу соединения: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y:z= 3/12 : 0,5/1; x:y:z= 0,25 : 0,5 = 1: 2. Значит простейшая формула этого соединения CH2, а его молярная масса 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H) = 12 + 2×1 = 12 + 2 = 14 / моль]. Чтобы определить истинную (молекулярную) формулу газа необходимо найти отношение истинной и полученной молярных масс. Известно, что один литр этого газа (н.у.) имеет массу 1,25 г. Тогда истинная молярная масса газа будет равна: V = n × Vm; n = V / Vm. m = n × M; n = m / M. V / Vm = m / M; M = m×Vm / V; M = 1,25 × 22,4 / 1 = 28 г/моль. Отношение истинной и полученной молярных масс равно: Msubstance / M(CH2) = 28 / 14 = 2. Значит индексы атомов углерода и водорода должны быть в 2 раза выше, т.е. формула газа будет иметь вид C2H4. Это этилен. |
| Ответ | C2H4. Это этилен |











