Агрегатные состояния вещества
Вещества имеют сложное строение. Частицы в веществе взаимодействуют между собой. Характер взаимодействия частиц в веществе определяет его агрегатное состояние.
Виды агрегатных состояний
Выделяют следующие агрегатные состояния: твердое, жидкое, газ, плазма.
В твердом состоянии частицы, как правило, объединены в правильную геометрическую структуру. Энергия связей частиц больше, чем энергия их тепловых колебаний.
Если температуру тела увеличивать, увеличивается энергия тепловых колебаний частиц. При некоторой температуре энергия тепловых колебаний становится больше, чем энергия связей. При такой температуре связи между частицами разрушаются и образуются снова. При этом частицы совершают различные виды движений (колебания, вращения, перемещения друг относительно друга и т.д.). При этом они еще контактируют между собой. Правильная геометрическая структура нарушена. Вещество находится в жидком состоянии.
При дальнейшем росте температуры тепловые колебания усиливаются, связи между частицами становятся еще слабее и практически отсутствуют. Вещество находится в газообразном состоянии. Самой простой моделью вещества является идеальный газ, в котором считается, что частицы движутся в любых направлениях свободно, взаимодействуют между собой только в момент соударений, при этом выполняются законы упругого удара.
Можно сделать вывод о том, что с ростом температуры вещество переходит от упорядоченной структуры в неупорядоченное состояние.
Плазма – это газообразное вещество, состоящее из смеси нейтральных частиц ионов и электронов.
Температура и давление в разных агрегатных состояниях вещества
Разные агрегатные состояния вещества определяют: температура и давление. Низкое давление и высокая температура соответствуют газам. При низких температурах, обычно вещество находится в твердом состоянии. Промежуточные температуры относят к веществам в жидком состоянии. Для характеристики агрегатных состояний вещества часто применяется фазовая диаграмма. Это диаграмма, отражающая зависимость агрегатного состояния от давления и температуры.
Основной особенностью газов является их способность к расширению и сжимаемость. Газы не обладают формой, принимают форму сосуда, в который помещены. Объем газа определяет объем сосуда. Газы могут смешиваться между собой в любых пропорциях.
Жидкость не имеет формы, но имеют объем. Сжимаются жидкости плохо, только при высоком давлении.
Твердые вещества имеют форму и объем. В твердом состоянии могут находиться соединения с металлическими, ионными и ковалентными связями.
Примеры решения задач
| Задание | Изобразите фазовую диаграмму состояний для некоего абстрактного вещества. Объясните ее смысл. |
| Решение | Сделаем рисунок.
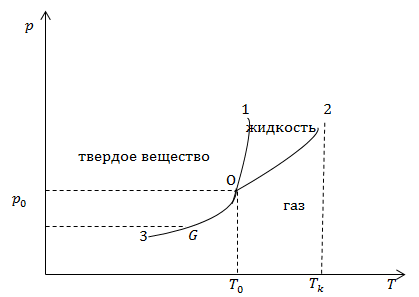
Рис. 1 Диаграмма состояния приведена на рис.1. Она состоит из трех областей, которые соответствуют кристаллическому (твердому) состоянию вещества, жидкости и газообразному состоянию. Данные области разделяются кривыми, которые обозначают границы взаимно обратных процессов: 01 – плавление – кристаллизация; 02 – кипение – конденсация; 03 – сублимация – десублимация. Точка пересечения всех кривых (О) – тройная точка. В этой точке вещество может существовать в трёх агрегатных состояниях. Если температура вещества выше критической ( |
| Задание | Объясните, что отличает одно агрегатное состояние от другого? |
| Решение | В различных агрегатных состояниях атомы (молекулы) имеют разные расположения. Так атомы (молекулы или ионы) кристаллических решеток расположены упорядоченно, могут совершать небольшие колебания около положений равновесия. Молекулы же газов находятся в неупорядоченном состоянии и могут перемещаться на значительные расстояния. Кроме того, внутренняя энергия веществ в разных агрегатных состояниях (для одинаковых масс вещества) при разных температурах различна. Процессы перехода из одного агрегатного состояния в другое сопровождаются изменением внутренней энергии. Переход: твердое вещество – жидкость – газ, означает увеличение внутренней энергии, так как происходит увеличение кинетической энергии движения молекул. |











