Бор и его характеристики
Общая характеристика бора
Бор сравнительно мало распространен в природе; общее содержание в земной коре составляет около 10-3% (масс.).
К главным природным соединениям бора относятся борная кислота H3BO3 и соли борных кислот, из которых наиболее известна бура Na2B4O7×10H2O.
В обычных условиях бор представляет собой вещество кристаллической структуры (ромбоэдрическая сингония) темно-серого цвета (рис.1). Тугоплавок (температура плавления 2075oС, температура кипения 3700oС), диамагнитен, обладает полупроводниковыми свойствами.

Рис. 1. Бор. Внешний вид.
Атомная и молекулярная масса бора
Относительная молекулярная масса Mr – это молярная масса молекулы, отнесенная к 1/12 молярной массы атома углерода-12 (12С). Это безразмерная величина.
Относительная атомная масса Ar – это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12 (12С).
Поскольку в свободном состоянии бор существует в виде одноатомных молекул В, значения его атомной и молекулярной масс совпадают. Они равны 10,806.
Аллотропия и аллотропные модификации бора
Для бора характерно проявление аллотропии, т.е. существование в виде нескольких простых веществ, называемых аллотропными (аллотропическими) модификациями. Во-первых, бор существует в двух агрегатных состояниях – кристаллическом (окрашен в серый цвет) и аморфном (окрашен в белый цвет). Во-вторых, в кристаллической форме бор имеет более 10 аллотропных модификаций. Например, атомы бора могут быть объединены в группировки B12, имеющие форму икосаэдра – двадцатигранника (рис. 2).
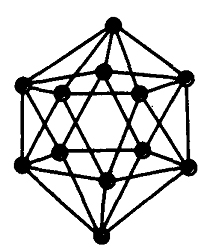
Рис. 2. Икосаэдрическая группировка атомов бора B12.
Эти икосаэдры B12,в свою очередь, могут располагаться относительно друг друга в кристалле по разному:
Изотопы бора
В природе бор существует в виде двух стабильных изотопов 10B (19,8%) и 11B (80,2%). Их массовые числа равны 10 и 11 соответственно. Ядро атома изотопа бора 10B содержит пять протонов и пять нейтронов, а изотопа 11B – такое же количество протонов и четыре нейтрона.
Существует двенадцать искусственных (радиоактивных) изотопов бора с массовыми числами от 5-ти до 17-ти, из которых наиболее устойчивым является 8B с периодом полураспада равным 0,77 с.
Ионы бора
На внешнем энергетическом уровне атома бора имеется три электрона, которые являются валентными:
+5B)2)3;
1s22s22p1.
В результате химического взаимодействия бор может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженный ион (B3+) или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженный ион (B3-):
B0 –3e → B3+;
B0+3e → B3-.
Молекула и атом бора
В свободном состоянии бор существует в виде одноатомных молекул В. Приведем некоторые свойства, характеризующие атом и молекулу бора:
|
Энергия ионизации атома, эВ |
8,39 |
|
Относительная электроотрицательность |
2,04 |
|
Радиус атома, нм |
0,091 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
561,6 |
Сплавы бора
В металлургии бор применяется как добавка к стали и к некоторым цветным сплавам. Присадка очень небольших количеств бора уменьшает размер зерна, что приводит к улучшению механических свойств сплавов. Применяется также поверхностное насыщение стальных изделий бором – борирование, повышающее твердость и стойкость против коррозии.
Примеры решения задач
| Задание | Определите относительную атомную массу бора, если известно, что массовая доля изотопа 10B равна 19,6%, а 11В – 80,4%. |
| Решение | Изотопы – это атомы одного и того же химического элемента, имеющие разные массовые числа (одинаковое число протонов, но разное – нейтронов). Средняя относительная масса изотопов рассчитывается по формуле:
Ar = (Ar1 ×ω1 + Ar2 ×ω2)/100. Рассчитываем среднюю относительную атомную массу бора: Ar(B) = (10 × 19,6 + 11 × 80,4)/100 = 10,8 а.е.м. |
| Ответ | Ar(B) = 10,8 а.е.м |
| Задание | Найдите формулу соединения бора с водородом (борана), имеющего состав в массовых долях процента: бора – 78,2; водорода – 21,8. Если масса 1 см 3 этого газа равна массе 1 см 3 азота. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим количество моль элементов, входящих в состав соединения за «х» (бор), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(B)/Ar(B) : ω(H)/Ar(H); x:y= 78,2/11 : 21,8/1; x:y= 7,12 : 21,8= 1 : 3. Значит простейшая формула соединения бора с водородом (борана) будет иметь вид BH3 и молярную массу 14 г/моль [M(BH3) = Ar(B) + 3×Ar(H) = 11+ 3×1 = 14 г/моль]. Согласно условию задачи: m(N2) = M(N2) × V(N2) / Vm = 28 × 1 / 22,4 = 1,25 г. m(BxHy) = M(BxHy) × V(BxHy) / Vm = M(BxHy) × 1 / 22,4. m(N2) = m(BxHy) = M(BxHy) × 1 / 22,4; M(BxHy) = m(N2) ×22,4 = 1,25 × 22,4 = 28 г/моль. Чтобы найти истинную формулу вещества найдем отношение полученных молярных масс: M(BxHy) / M(BH3) = 28 / 12 = 2. Значит индексы атомов бора и водорода должны быть в 2 раза выше, т.е. формула борана будет иметь вид B2H6. |
| Ответ | B2H6 |











